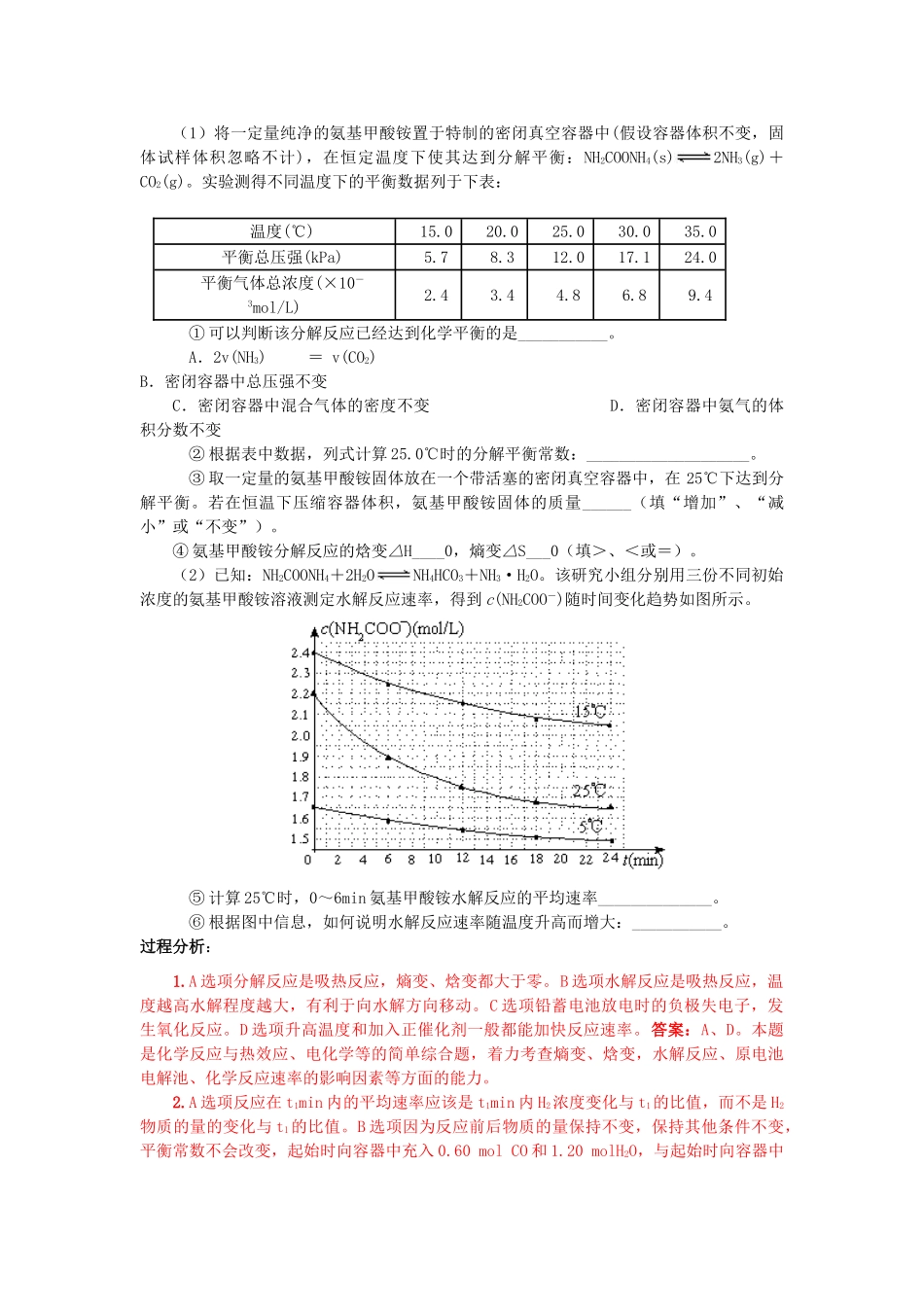
专题 7.解决化学反应速率、化学平衡问题考试说明中:①了解化学反应速率的概念和平均反应速率的定量表示方法。②了解温度、浓度、压强和催化剂等影响化学反应速率的一般规律。③认识催化剂在生产、生活和科学研究领域中的重大作用。④了解化学反应的可逆性。能用焓变和熵变说明常见简单化学反应的方向。⑤理解化学平衡和化学平衡常数的含义。⑥理解浓度、温度、压强、催化剂等对化学平衡影响的一般规律。⑦认识化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。高考试卷中:江苏高考试卷中在选择题中一道完全是化学反应速率、化学平衡方面试题,另外有一道选择题与化学反应速率、化学平衡方面相关的试题。在非选择题中,化学反应速率、化学平衡方面知识在化学反应原理综合题中呈现出来。由于化学反应速率和化学平衡是高中化学课程的重点和难点内容, 每年均有该内容试题出现,且难度和分值有上升趋势,有的题目甚至达到选拔优秀的难度。答题过程中:要认真审题,合理运用平衡移动原理、化学平衡常数、图象题的解法与思路转化率大小变化的判断、等效平衡各方面知识,有针对性、准确答题。一.能力展示1. 下列说法正确的是A. 一定温度下,反应 MgCl2(1) === Mg(1)+ Cl2(g)的 △H>0 △S>0B. 水解反应 NH4++H2ONH3·H2O+H+达到平衡后,升高温度平衡逆向移动C. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应D. 对于反应 2H2O2 === 2H2O+O2↑,加入 MnO2或升高温度都能加快 O2的生成速率2.700℃时,向容积为 2L 的密闭容器中充入一定量的 CO 和 H2O,发生反应:CO(g)+H2O(g) CO2+H2(g) 反应过程中测定的部分数据见下表(表中 t1>t2):反应时间/minn(CO)/molH2O/ mol01.200.60t10.80 t2 0.20下列说法正确的是A. 反应在 t1min 内的平均速率为 v(H2)=0.40/t1 mol·L-1·min-1B. 保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,到达平衡时,n(CO2)=0.40 mol。C. 保持其他条件不变,向平衡体系中再通入 0.20 mol H2O,与原平衡相比,达到新平衡时 CO 转化率增大,H2O 的体积分数增大D. 温度升至 800℃,上述反应平衡常数为 0.64,则正反应为吸热反应3. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计...