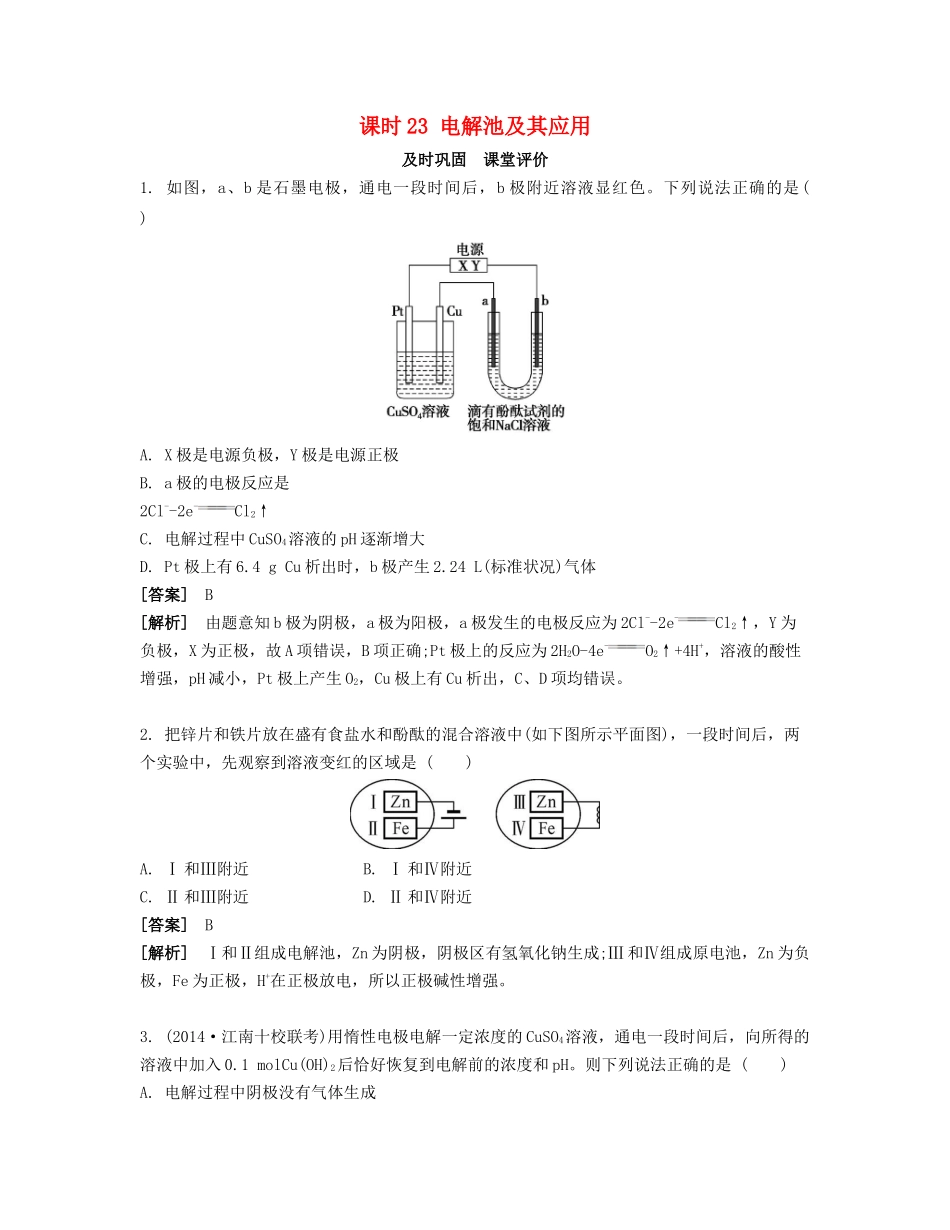
课时23电解池及其应用及时巩固课堂评价1.如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是()A.X极是电源负极,Y极是电源正极B.a极的电极反应是2Cl--2e-Cl2↑C.电解过程中CuSO4溶液的pH逐渐增大D.Pt极上有6.4gCu析出时,b极产生2.24L(标准状况)气体[答案]B[解析]由题意知b极为阴极,a极为阳极,a极发生的电极反应为2Cl--2e-Cl2↑,Y为负极,X为正极,故A项错误,B项正确;Pt极上的反应为2H2O-4e-O2↑+4H+,溶液的酸性增强,pH减小,Pt极上产生O2,Cu极上有Cu析出,C、D项均错误。2.把锌片和铁片放在盛有食盐水和酚酞的混合溶液中(如下图所示平面图),一段时间后,两个实验中,先观察到溶液变红的区域是()A.Ⅰ和Ⅲ附近B.Ⅰ和Ⅳ附近C.Ⅱ和Ⅲ附近D.Ⅱ和Ⅳ附近[答案]B[解析]Ⅰ和Ⅱ组成电解池,Zn为阴极,阴极区有氢氧化钠生成;Ⅲ和Ⅳ组成原电池,Zn为负极,Fe为正极,H+在正极放电,所以正极碱性增强。3.(2014·江南十校联考)用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是()A.电解过程中阴极没有气体生成B.电解过程中转移的电子的物质的量为0.4molC.原CuSO4溶液的浓度为0.1mol·L-1D.电解过程中阳极收集到的气体体积为1.12L(标准状况下)[答案]B[解析]由2CuSO4+2H2O2Cu+2H2SO4+O2↑知,如CuSO4未电解完,加CuO即可复原,而Cu(OH)2相当于CuO·H2O,故CuSO4电解完后,还电解了部分水。电解析出了0.1molCu,转移电子0.2mol,而电解0.1molH2O转移电子0.2mol,故转移的电子的总物质的量为0.4mol。4.铅蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+2Pb2++2H2O。下列有关新型液流式铅酸蓄电池的说法正确的是()A.充、放电时,溶液中Pb2+浓度保持不变B.放电时,其原理是电解池C.放电时的负极反应式:Pb-2e-Pb2+D.充电时的阳极反应式:Pb2++4OH-+2e-PbO2+2H2O[答案]C[解析]A项,放电时,生成Pb2+,c(Pb2+)增大,充电时,要消耗Pb2+,c(Pb2+)减小,错。B项,放电时是原电池工作原理,错。C项,负极是失去电子的一极,也是化合价升高的一极,即Pb从0价升高至+2价,正确。D项,阳极发生氧化反应,即还原剂失电子,错。【参考答案】问题思考问题1原电池电解池能量转化化学能→电能电能→化学能反应特征自发反应非自发反应电极名称由电极材料本身决定负极:活泼金属正极:不活泼金属(非金属导体)由连接电源的正、负极决定阴极:与负极相连阳极:与正极相连装置特征无电源两极材料一般不同有直流电源两极材料相同,也可不同联系两者都是在两电极上发生氧化还原反应问题2①溶液中存在阳离子:Cu2+、H+;阴离子:OH-、S。②判断阴、阳两极离子放电顺序:阳极OH->S;阴极Cu2+>H+。③写出电极反应式及总反应式:阳极:4OH--4e-O2↑+2H2O;阴极:2Cu2++4e-2Cu;总反应式:2CuSO4+2H2O2Cu+O2↑+2H2SO4。基础梳理考点1:1.电能化学能正极负极3.(1)正失氧化负得还原(2)①负阴阳正②阴阳4.(1)金属离子S2-、I-、Br-、Cl-、OH-、含氧酸根离子(N、S、C)、F-考点2:1.(1)2Cl--2e-Cl2↑2Na++2e-2Na2NaCl(熔融)2Na+Cl2↑(2)粗铜纯铜可溶性铜盐不变2.(1)金属或合金阴极负阳极2-4O2-4O-3O2-4O2-3O