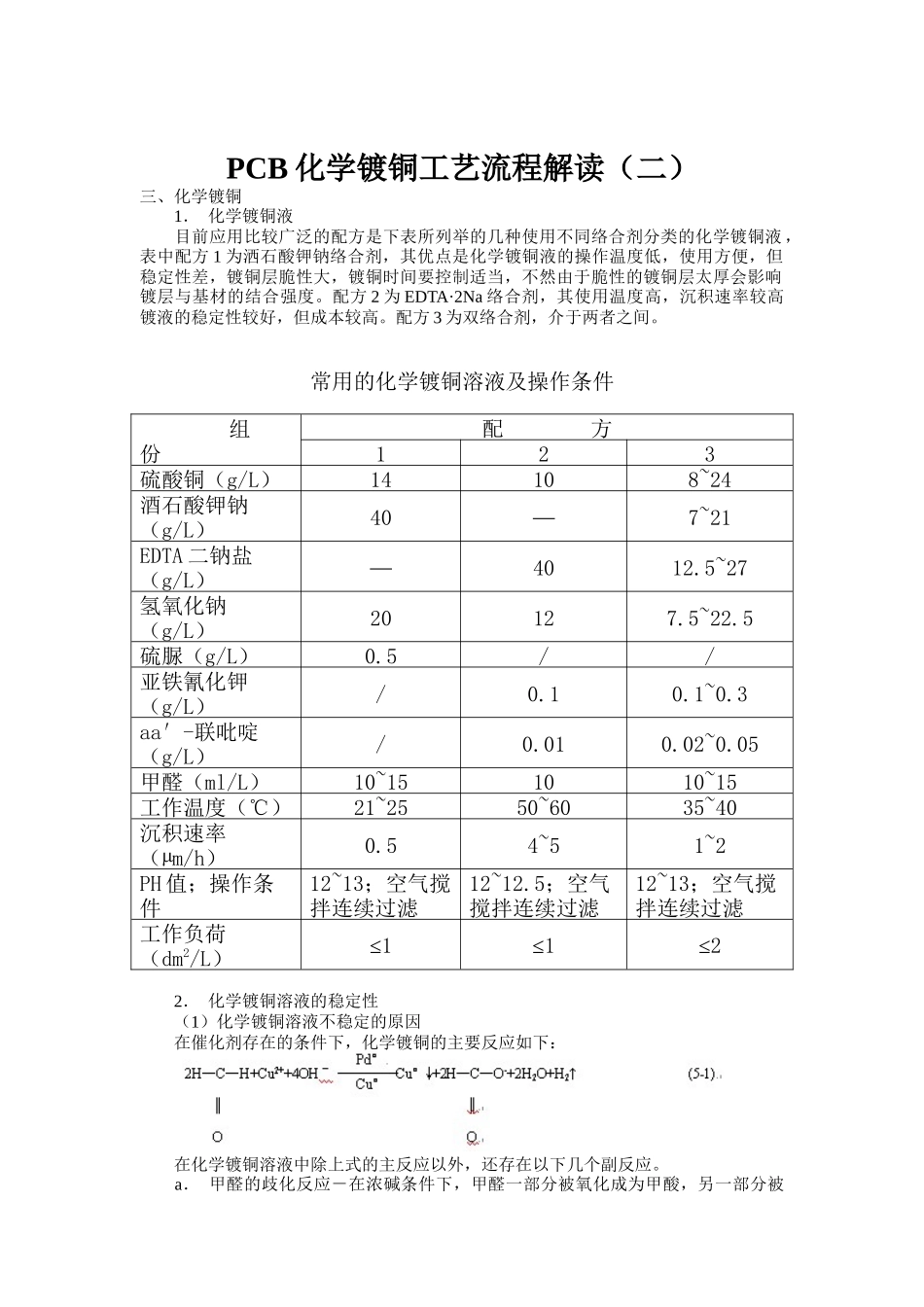
PCB化学镀铜工艺流程解读(二)三、化学镀铜1.化学镀铜液目前应用比较广泛的配方是下表所列举的几种使用不同络合剂分类的化学镀铜液,表中配方1为洒石酸钾钠络合剂,其优点是化学镀铜液的操作温度低,使用方便,但稳定性差,镀铜层脆性大,镀铜时间要控制适当,不然由于脆性的镀铜层太厚会影响镀层与基材的结合强度。配方2为EDTA·2Na络合剂,其使用温度高,沉积速率较高镀液的稳定性较好,但成本较高。配方3为双络合剂,介于两者之间。常用的化学镀铜溶液及操作条件组份配方123硫酸铜(g/L)14108~24酒石酸钾钠(g/L)40—7~21EDTA二钠盐(g/L)—4012.5~27氢氧化钠(g/L)20127.5~22.5硫脲(g/L)0.5//亚铁氰化钾(g/L)/0.10.1~0.3aa′-联吡啶(g/L)/0.010.02~0.05甲醛(ml/L)10~151010~15工作温度(℃)21~2550~6035~40沉积速率(µm/h)0.54~51~2PH值;操作条件12~13;空气搅拌连续过滤12~12.5;空气搅拌连续过滤12~13;空气搅拌连续过滤工作负荷(dm2/L)≤1≤1≤22.化学镀铜溶液的稳定性(1)化学镀铜溶液不稳定的原因在催化剂存在的条件下,化学镀铜的主要反应如下:在化学镀铜溶液中除上式的主反应以外,还存在以下几个副反应。a.甲醛的歧化反应-在浓碱条件下,甲醛一部分被氧化成为甲酸,另一部分被还原成甲醇,反应式为甲醛的歧视化反应除造成甲醛过量的消耗外,还会使镀液过早的"老化",使镀液不稳定。b.在碱性镀铜溶液中,甲醛还原一部分Cu2+为Cu+,其反应式为反应式(5-3)所生成的Cu2O在碱性溶液中是微溶的:Cu2O+H2O===2Cu++2OH--(5-4)反应(5-4)中出现的铜Cu+非常容易发生歧化反应2Cu+===Cu0↓+Cu2+(5-5)反应式(5-5)所生成的铜是极细小的微粒,它们无规则地分散在化学镀铜液中,这些铜微粒具有催化性,如果对这些铜微粒不进行控制,则迅速地导致整个镀液分解,这是造成化学镀铜液不稳定的主要原因。(2)提高化学镀铜溶液稳定性的措施a.加稳定剂所加入的稳定剂对Cu+有极强的络合能力,对溶液中的Cu2+离子络合能力较差,这种溶液中的Cu+离子不能产生歧化反应,因而能起到稳定化学镀铜液的作用。所加入的稳定剂一般是含硫或N的化合物。例如:a,a′联吡啶、亚铁氰化钾,2,9二甲基邻菲罗林、硫脲、2-巯基苯骈噻唑等。b.气搅拌化学镀铜过程中,用空气搅拌溶液,在一定程度上可抑制Cu2O的产生,从而起到稳定溶液的作用。c.连续过滤用粒度5μm的滤芯连续过滤化学镀铜液,可以随时滤除镀液中出现的活性颗粒物质。d.加入高分子化合物掩蔽铜颗粒很多含有羟基、醚基高分子化合物能吸附在铜的表面上。这样,由于Cu2O的歧化反应而生成的铜颗粒,在其表面上吸附了这些高分子化合物之后就会失去催化性能,不再起分解溶液的作用。最常用的高分子化合物有聚乙二醇、聚乙二醇硫醚等。e.控制工作负荷对于不同的化学镀铜液具有不同的工作负荷,如果"超载"就会加速化学镀铜液的分解。对于表4所举的化学镀铜液工作负荷在连续工作时一般不能大于1dm2/L。3.化学镀铜层的韧性为了保证PCB金属化孔连接的可靠性,化学镀铜层必须具有足够的韧性。化学镀铜层韧性差的主要原因是由于甲醛还原Cu2时,放出氢气引起的。虽然氢气不能和铜共沉积,但在镀铜反应中,这些氢气会吸附在铜的表面上,聚集成气泡夹杂在镀铜层中,使镀铜层产生大量的气泡空洞,这些空洞会使化学镀铜层的电阻变高,韧性变差。提高化学镀铜层韧性的主要措施是在镀液中加入阻氢剂,防止氢气在铜层表面聚积。下表列举了a,a′联吡啶与其它的添加剂联合使用时对以EDTA为络合剂的化学镀铜液的镀铜层韧性影响,镀铜温度为70℃,a,a′联吡啶的加入量为100mg/L。5某些添加剂对镀层韧性的影响添加剂名称用量(mg/L)沉积速度µm/h弯折次数2-巯基苯骈噻唑10100a,a′硫代乙二醇108~106~12亚铁氰化钾106~89~13硫氰化钾106~89~134.化学镀液的沉积速率影响化学镀铜液沉积速率的因素主要有以下几点:(1)溶液的的pH值甲醛还原铜的反应能否顺利进行,主要取决于镀液的pH值,在一定pH值范围内,随着溶液pH值增加,铜的沉积速度率加快,但pH值也不能太高,否则副反应加剧,造成镀液不稳定。一般情况下pH值的控制范围为1...