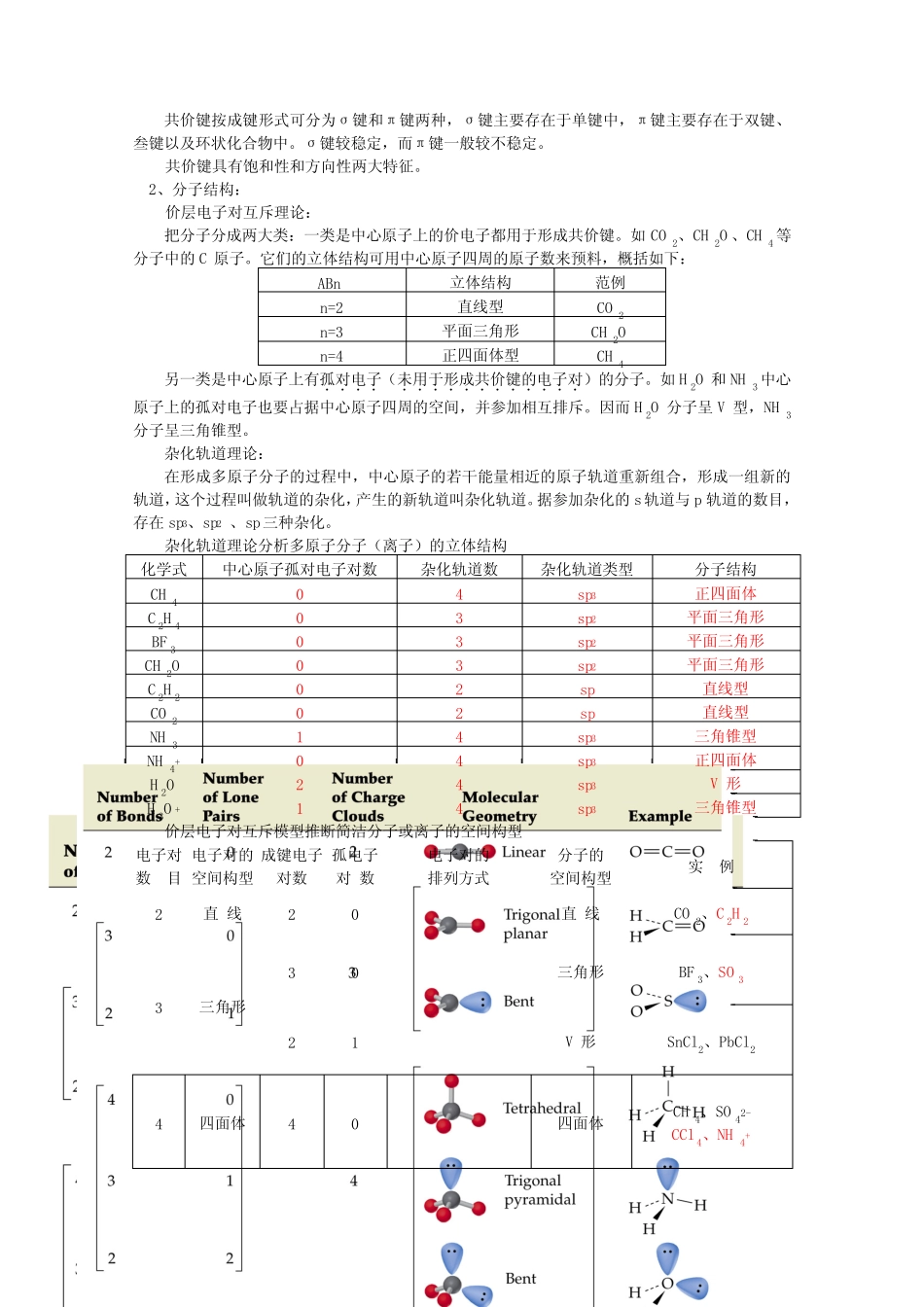
年级高三学科化学版本苏教版内容标题高三其次轮复习:分子结构与晶体结构【本讲教化信息】一.教学内容:分子结构与晶体结构二.教学目标了解化学键的含义,理解并驾驭共价键的主要类型及特点,共价键、离子键及金属键的主要区分及对物质性质的影响。能依据杂化轨道理论和价层电子对互斥模型推断简洁分子或离子的空间构型,了解等电子体的含义。了解原子晶体、分子晶体和金属晶体的结构特征,驾驭不同晶体的构成微粒及微粒间的相互作用力,驾驭影响晶体熔沸点、溶解性的因素。三.教学重点、难点分子结构与晶体结构的特点,影响物质熔沸点和溶解性、酸性的因素四.教学过程(一)化学键与分子结构:1、化学键:相邻的两个或多个原子之间剧烈的相互作用,通常叫做化学键。三种化学键的比较:离子键共价键金属键形成过程阴阳离子间的静电作用原子间通过共用电子对所形成的相互作用金属阳离子与自由电子间的相互作用构成元素典型金属(含NH4+)和典型非金属、含氧酸根非金属金属实例离子化合物,如典型金属氧化物、强碱、大多数盐多原子非金属单质、气态氢化物、非金属氧化物、酸等金属配位键:配位键属于共价键,它是由一方供应孤对电子,另一方供应空轨道所形成的共价键,例如:NH4+的形成在NH4+中,虽然有一个N-H键形成过程与其它3个N-H键形成过程不同,但是一旦形成之后,4个共价键就完全相同。共价键的三个键参数概念意义键长分子中两个成键原子核间距离(米)键长越短,化学键越强,形成的分子越稳定键能对于气态双原子分子AB,拆开1molA-B键所需的能量键能越大,化学键越强,越坚固,形成的分子越稳定键角键与键之间的夹角键角确定分子空间构型键长、键能确定共价键的强弱和分子的稳定性:原子半径越小,键长越短,键能越大,分子越稳定。共价键的极性极性键非极性键共用电子对偏移程度偏移不偏移构成元素不同种非金属元素同种非金属元素实例HCl、H2O、CO2、H2SO4H2、N2、Cl2共价键按成键形式可分为σ键和π键两种,σ键主要存在于单键中,π键主要存在于双键、叁键以及环状化合物中。σ键较稳定,而π键一般较不稳定。共价键具有饱和性和方向性两大特征。2、分子结构:价层电子对互斥理论:把分子分成两大类:一类是中心原子上的价电子都用于形成共价键。如CO2、CH2O、CH4等分子中的C原子。它们的立体结构可用中心原子四周的原子数来预料,概括如下:ABn立体结构范例n=2直线型CO2n=3平面三角形CH2On=4正四面体型CH4另一类是中心原子上有孤对电子....(未用于形成共价键的电子对............)的分子。如H2O和NH3中心原子上的孤对电子也要占据中心原子四周的空间,并参加相互排斥。因而H2O分子呈V型,NH3分子呈三角锥型。杂化轨道理论:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。据参加杂化的s轨道与p轨道的数目,存在sp3、sp2、sp三种杂化。杂化轨道理论分析多原子分子(离子)的立体结构化学式中心原子孤对电子对数杂化轨道数杂化轨道类型分子结构CH404sp3正四面体C2H403sp2平面三角形BF303sp2平面三角形CH2O03sp2平面三角形C2H202sp直线型CO202sp直线型NH314sp3三角锥型NH4+04sp3正四面体H2O24sp3V形H3O+14sp3三角锥型价层电子对互斥模型推断简洁分子或离子的空间构型电子对数目电子对的空间构型成键电子对数孤电子对数电子对的排列方式分子的空间构型实例2直线20直线CO2、C2H23三角形30三角形BF3、SO321V形SnCl2、PbCl24四面体40四面体CH4、SO42-CCl4、NH4+31三角锥NH3、PCl322V形H2O、H2S说明:(1)等电子原理是指原子总数相同,价电子总数相同的分子或离子,对于主族元素而言,价电子就是其最外层电子数,即为最外层电子总数相等。这一类分子或离子具有相像的化学键特征、分子结构以及部分物理性质相像,但一般状况下,化学性质并不相像。同样,化学键相像,并不是指键角等肯定相同。利用等电子原理可推断一些简洁分子或离子的主体构型,如:CO2、CNS-、NO2+、N3-的原子总数均为3,价电子总数均为16,因此,它们的空间构型均为直线型。(2)运用价层...