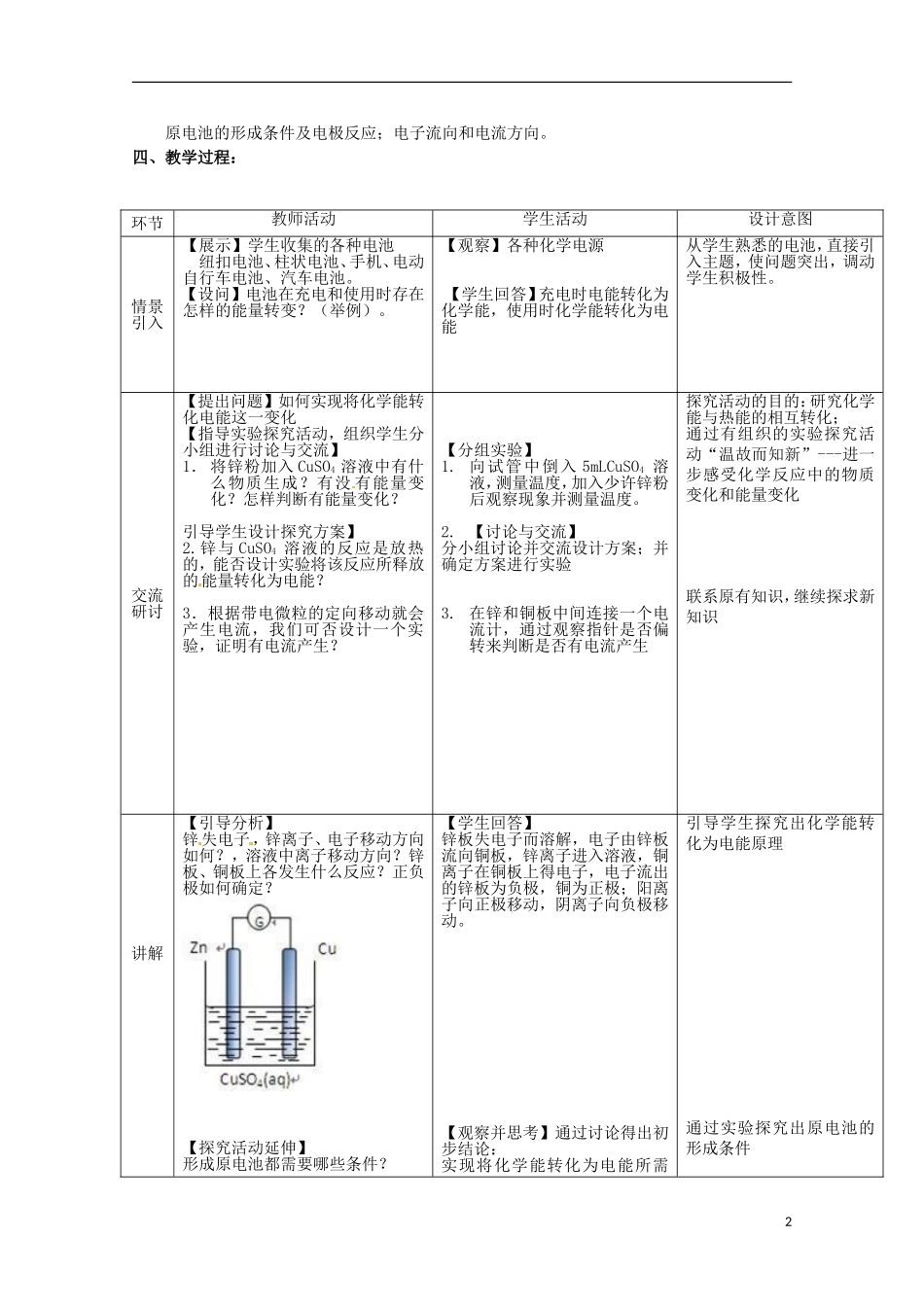
《化学反应原理》第1章第3节《化学能转化为电能》第一课时教材分析:《化学反应原理》第一章主要研究化学反应与能量转化,第1节着重研究了化学反应与热能的关系,而第2、3节电化学基础着重研究化学反应与电能的关系。电化学知识是在必修1“氧化还原”、必修2“化学反应的应用”等知识的进一步拓宽和加深,是“氧化还原”、“化学反应与能量”的学习的延续。原电池作为电化学的基础,应用十分广泛。利用其原理可制成多种电池,在工农业生产,以及日常生活等方面都有广泛的用途。另一个重要意义是从本质上认识金属的腐蚀,找到金属防护的方法,通过实验培养学生的动手能力、实验技能和应用所学知识解决实际问题的能力。设计思路:教师创设实验情景,学生通过思考质疑,沿着化学反应中能量变化的思路,设计、动手实验探讨原电池原理。具体过程:1.让学生收集尽可能多的、易得的材料和物品,并分组设计实验方案,分组尝试,探索怎样能产生电流,要产生电流,实现化学能转化为电能,需什么条件,对这些条件的归纳分析,形成了对原电池反应原理的认识。2.根据实验现象怎样确定正、负极?铜片和锌片表面发生哪些反应?3.构成原电池需要哪些条件?学生能强烈地体会到一种成就感,学习带给他们的喜悦油然而生,实现教学目的。一、教学目标:1.知识与技能:进一步了解原电池的工作原理,能够写出原电池的电极反应和原电池反应方程式。过程与方法:2.通过原电池原理的探究活动,培养学生的推理和分析问题的能力以及能用氧化还原反应原理解决问题的能力。3.情感、态度与价值观:通过一些实验和科学探究活动,使学生增强探索化学反应原理的兴趣,树立学习和研究化学的志向。教学重点:电解的原理教学难点:阴极和阳极以及电板反应的概念,正确书写电极反应式。二、教学重点:原电池的工作原理。三、教学难点:1原电池的形成条件及电极反应;电子流向和电流方向。四、教学过程:环节教师活动学生活动设计意图情景引入【展示】学生收集的各种电池纽扣电池、柱状电池、手机、电动自行车电池、汽车电池。【设问】电池在充电和使用时存在怎样的能量转变?(举例)。【观察】各种化学电源【学生回答】充电时电能转化为化学能,使用时化学能转化为电能从学生熟悉的电池,直接引入主题,使问题突出,调动学生积极性。交流研讨【提出问题】如何实现将化学能转化电能这一变化【指导实验探究活动,组织学生分小组进行讨论与交流】1.将锌粉加入CuSO4溶液中有什么物质生成?有没有能量变化?怎样判断有能量变化?引导学生设计探究方案】2.锌与CuSO4溶液的反应是放热的,能否设计实验将该反应所释放的能量转化为电能?3.根据带电微粒的定向移动就会产生电流,我们可否设计一个实验,证明有电流产生?【分组实验】1.向试管中倒入5mLCuSO4溶液,测量温度,加入少许锌粉后观察现象并测量温度。2.【讨论与交流】分小组讨论并交流设计方案;并确定方案进行实验3.在锌和铜板中间连接一个电流计,通过观察指针是否偏转来判断是否有电流产生探究活动的目的:研究化学能与热能的相互转化;通过有组织的实验探究活动“温故而知新”---进一步感受化学反应中的物质变化和能量变化联系原有知识,继续探求新知识讲解【引导分析】锌失电子,锌离子、电子移动方向如何?,溶液中离子移动方向?锌板、铜板上各发生什么反应?正负极如何确定?【探究活动延伸】形成原电池都需要哪些条件?【学生回答】锌板失电子而溶解,电子由锌板流向铜板,锌离子进入溶液,铜离子在铜板上得电子,电子流出的锌板为负极,铜为正极;阳离子向正极移动,阴离子向负极移动。【观察并思考】通过讨论得出初步结论:实现将化学能转化为电能所需引导学生探究出化学能转化为电能原理通过实验探究出原电池的形成条件2作业原电池工作原理同步练习题交流研讨(学生按下图装置完成实验)【演示实验】在烧杯中盛有稀H2SO4溶液,放入Cu丝,Ag丝用导线联结后,观察电流计指针位置有无变化【变换实验】改变两极材料的条件为氧化还原反应、容器、导线、用电器等【学生分组实验】用以下三种组合方式:a.Fe~Cub.Zn~Fec.Zn~C用导线分别夹住每一组合中的两种...