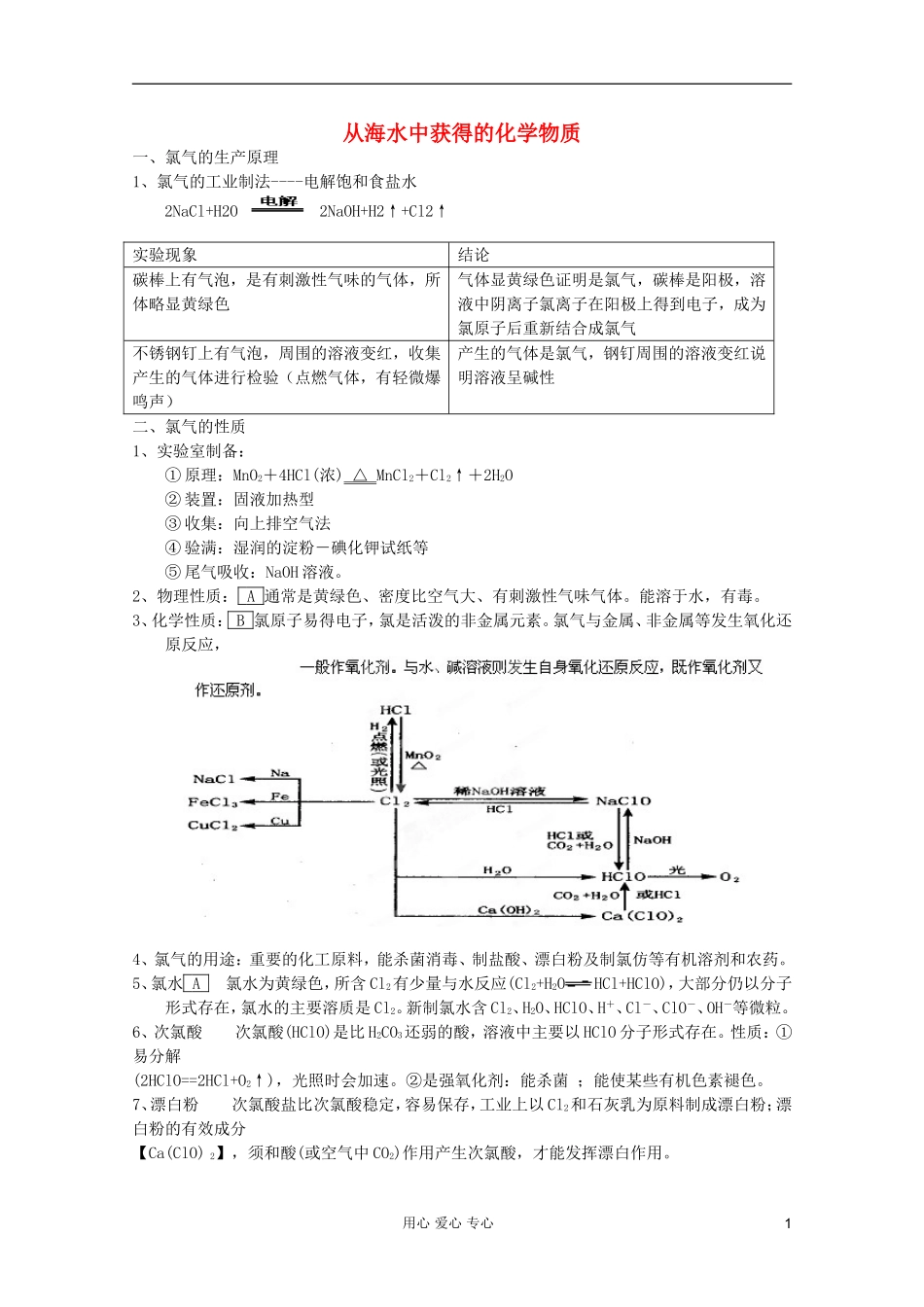
从海水中获得的化学物质一、氯气的生产原理1、氯气的工业制法----电解饱和食盐水2NaCl+H2O2NaOH+H2↑+Cl2↑实验现象结论碳棒上有气泡,是有刺激性气味的气体,所体略显黄绿色气体显黄绿色证明是氯气,碳棒是阳极,溶液中阴离子氯离子在阳极上得到电子,成为氯原子后重新结合成氯气不锈钢钉上有气泡,周围的溶液变红,收集产生的气体进行检验(点燃气体,有轻微爆鸣声)产生的气体是氯气,钢钉周围的溶液变红说明溶液呈碱性二、氯气的性质1、实验室制备:①原理:MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O②装置:固液加热型③收集:向上排空气法④验满:湿润的淀粉-碘化钾试纸等⑤尾气吸收:NaOH溶液。2、物理性质:A通常是黄绿色、密度比空气大、有刺激性气味气体。能溶于水,有毒。3、化学性质:B氯原子易得电子,氯是活泼的非金属元素。氯气与金属、非金属等发生氧化还原反应,4、氯气的用途:重要的化工原料,能杀菌消毒、制盐酸、漂白粉及制氯仿等有机溶剂和农药。5、氯水A氯水为黄绿色,所含Cl2有少量与水反应(Cl2+H2OHCl+HClO),大部分仍以分子形式存在,氯水的主要溶质是Cl2。新制氯水含Cl2、H2O、HClO、H+、Cl-、ClO-、OH-等微粒。6、次氯酸次氯酸(HClO)是比H2CO3还弱的酸,溶液中主要以HClO分子形式存在。性质:①易分解(2HClO==2HCl+O2↑),光照时会加速。②是强氧化剂:能杀菌;能使某些有机色素褪色。7、漂白粉次氯酸盐比次氯酸稳定,容易保存,工业上以Cl2和石灰乳为原料制成漂白粉;漂白粉的有效成分【Ca(ClO)2】,须和酸(或空气中CO2)作用产生次氯酸,才能发挥漂白作用。用心爱心专心1三、溴、碘的提取实验实验现象化学方程式氯水与溴化钾溶液反应分层,溶液由橙色变无色;底层(四氯化碳层)由无色变为橙红色Cl2+2NaBr=2NaCl+Br2氯水与碘化钾溶液反应分层,溶液由黄色变无色;底层(四氯化碳层)由无色变为红棕色Cl2+2NaI=2NaCl+I2溴水与碘化钾溶液反应分层,溶液由橙色变黄无色;底层(四氯化碳层)由无色变为红棕色Br2+2NaI=2NaBr+I2四、氧化还原反应C1、定义:有电子转移(或者化合价升降)的反应2、本质:电子转移(包括电子的得失和偏移)3、特征:化合价的升降氧化剂(具有氧化性)——得电子——化合价下降——被还原-------还原产物还原剂(具有还原性)——失电子——化合价上升——被氧化——氧化产物4、口诀:升---失----(被)氧化---(是)还原剂(生虱痒)降---得---(被)还原---(是)氧化剂6、金属活动顺序表KCaNaMgAlZnFeSnPbHCuHgAgPtAu还原性(金属性)逐渐减弱2钠、镁及其化合物一、钠的性质及应用B用心爱心专心21.钠及其化合物的转化关系2.钠的化学性质钠的化学性质很活泼,易失去电子被氧化,表现出强还原性:Na–eˉ=Na+(1)Na跟非金属(如Cl2、S、O2等)发生化合反应2Na+O2CombinNa2O2(淡黄色)Na+S=NaS(反应剧烈,可能爆炸)(2)Na跟水、酸、醇发生置换反应2Na+2H2O==2NaOH+H2↑(剧烈)离子方程式:2Na+2H2O=2Na++2OHˉ+H2↑2Na+2C2H50H→2C2H5ONa+H2↑(平稳)(3)Na与盐溶液反应。一般不跟溶液中金属离子作用,而是与水反应。必须考虑其产物(NaOH)与金属离子间的作用。例如,钠与硫酸铜溶液的反应,可认为是两步反应:2Na+2H2O=2NaOH+H2↑;2NaOH+CuSO4=Na2SO4+Cu(OH)2↓也可合并写为总反应方程式:2Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑钠与硫酸铜溶液反应的现象为:钠块浮于液面,熔成闪亮的小球,四处游动,放出气体并逐渐消失(以上现象与钠跟水的反应现象相同);溶液中则产生蓝色絮状沉淀。(4)Na还原其它金属4Na+4TiCl4CombinTi+4NaCl(工业制钛)3.钠的存在、保存、制备在自然界中,钠元素只能以化合态存在。主要存在形式有NaCl及Na2SO4、Na2CO3、NaNO3等。金属钠是人工制取的。制取原理:2NaCl(熔融)Combin2Na+Cl2↑实验室中通常将钠保存在煤油里,与空气隔绝。这是利用钠比煤油密度小,且不溶于煤油,也不与煤油反应的性质。二、Na2CO3的性质及应用D1.Na2CO3的工业制法:把CO2通入饱和了氨和食盐的溶液中NaCl+NH3+CO2+H2O==NaHCO3(结晶)+NH4Cl然后加热过滤出的NaHCO3晶体2NaHCO3CombinNa2CO3+CO2↑+H2O“侯氏制碱法”...