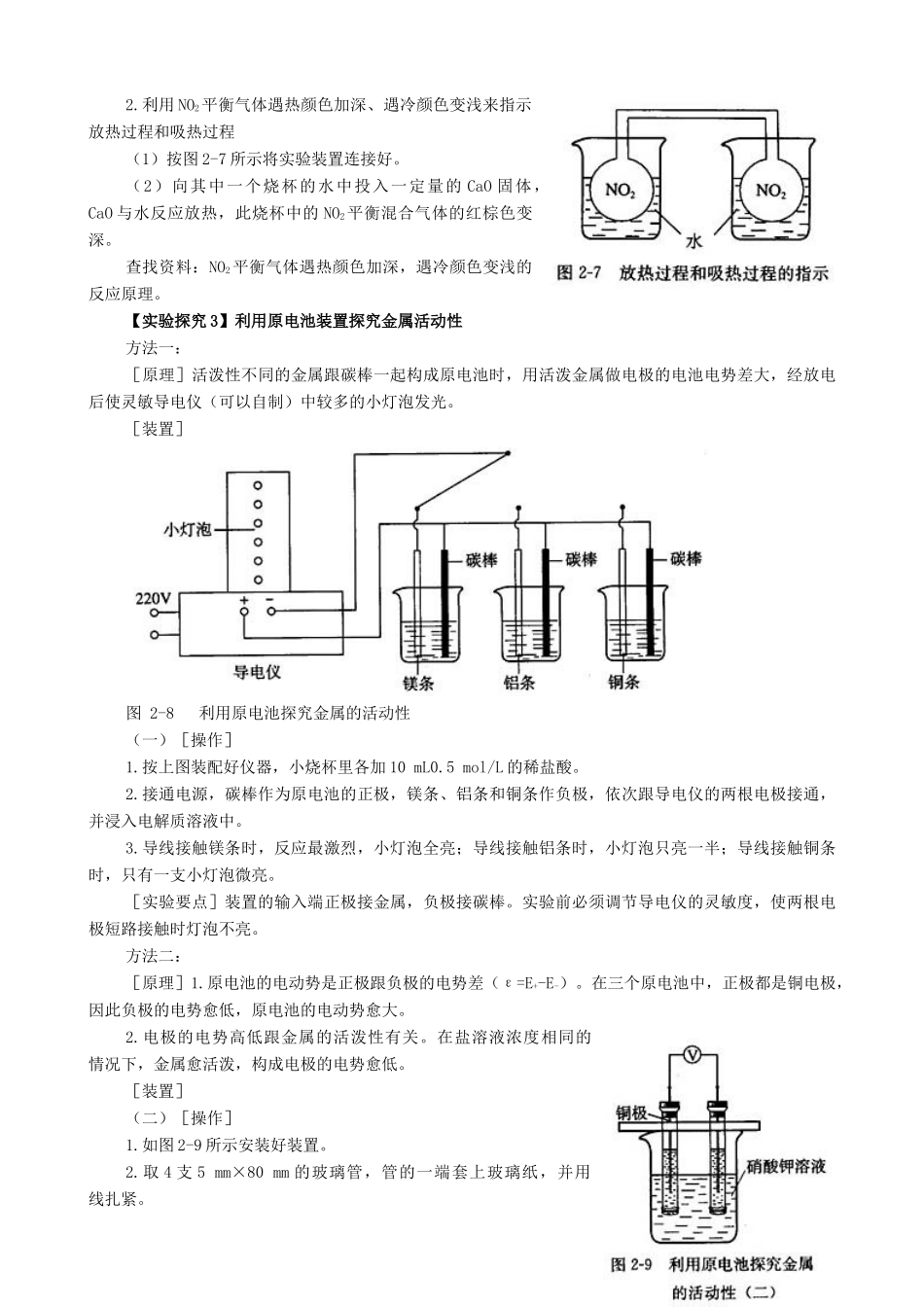
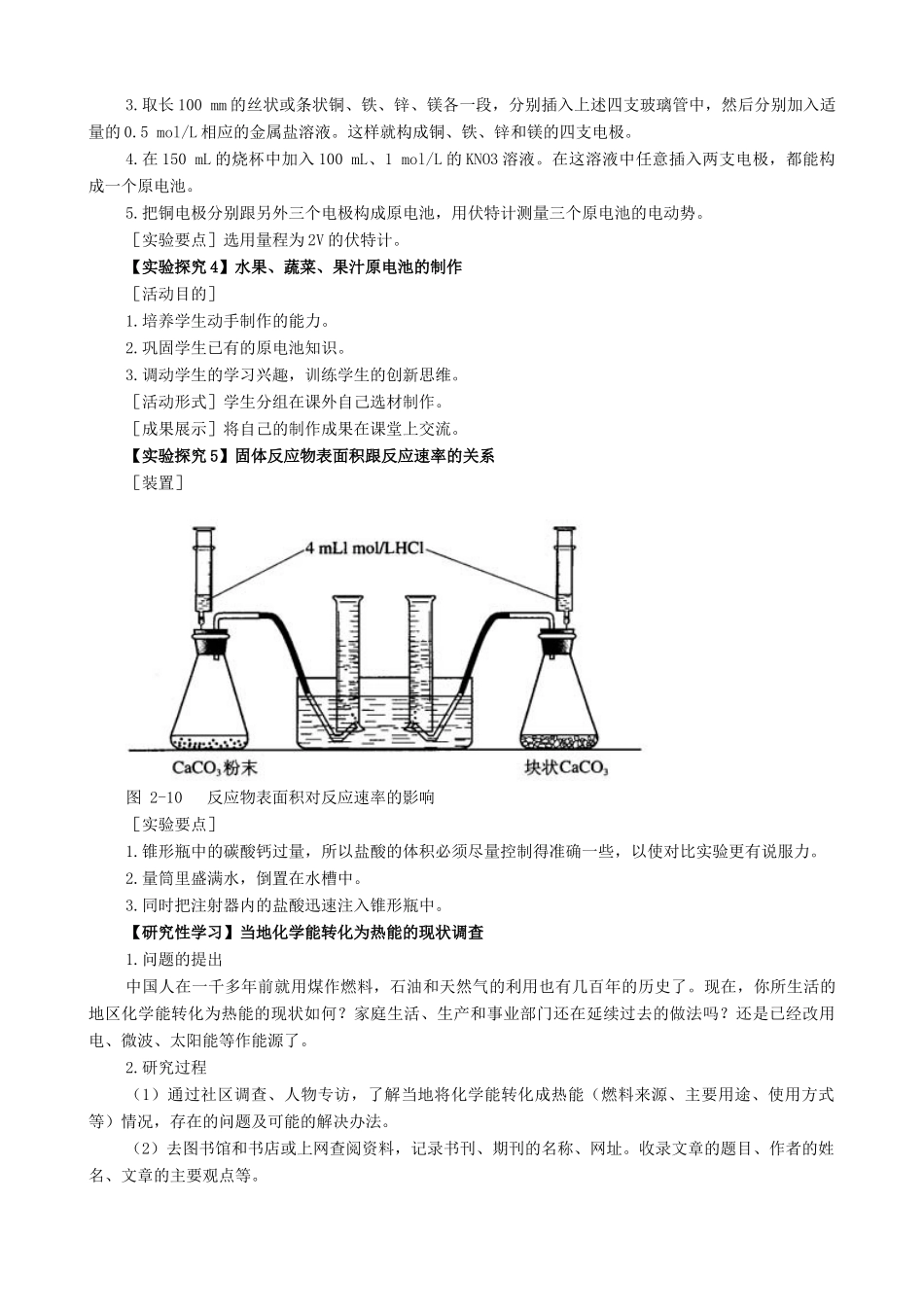
第二章化学反应与能量课外实践活动案例【实验探究1】中和热的近似测定1.用量筒(最好使用移液管)量取50mL1mol/L的盐酸,加入100mL的烧杯中,并用温度计测量盐酸的温度(tHCl),记录在下页表中。2.用另一支量筒量取50mL1mol/L的NaOH溶液,并用温度计测量NaOH溶液的温度(tNaOH),也记录在下页表中,并计算起始温度的平均值(t1)。3.把试管中的氢氧化钠溶液一次倒入盛盐酸的烧杯里,跟盐酸混合,随即盖上泡沫塑料板。搅拌溶液,然后读出混合液的最高温度(t2),记录在表内。4.根据上述测得的实验数据,按下式近似计算强酸强碱的中和热。中和热=(m×C×△t×10-3)/n(H2O)(kJ/mol)式中m是混合液的质量(把盐酸和氢氧化钠溶液的密度近似看作水的密度为1g/cm3来计算),C是混合液的比热容(近似取4.18kJ/kg·K),n(H2O)是中和反应生成水的物质的量(单位mol)。实验序号物质起始温度t1/℃终止温度t2/℃温差t2-t1/℃中和热/kJ/mol①HCltHCl=t1=(tHCl+tNaOH)/2=t2=t2-t1=NaOHtNaOH=②HCltHCl=t1=(tHCl+tNaOH)/2=t2=t2-t1=NaOHtNaOH=③HCltHCl=t1=(tHCl+tNaOH)/2=t2=t2-t1=NaOHtNaOH=5.重复上述实验2次,将实验结果填入上表格中。取三次平行实验结果的平均值。【实验探究2】放热反应的观察1.利用空气的热胀冷缩原理观察氧化钙与水反应放热(1)按图2-6所示将实验装置连接好。(2)在U型管内加入少量品红溶液(或红墨水)。打开T型管螺旋夹,使U型管内两边的液面处于同一水平面,再夹紧螺旋夹。(3)在中间的试管里盛1g氧化钙,当滴入2mL左右的蒸馏水后,可观察到U型玻管里的红墨水会沿开口端上升。也可以在小试管里盛浓盐酸,滴入氢氧化钠溶液,或在3%的过氧化氢溶液里加入少量的二氧化锰粉末,反应时都会放出热量,具支试管内的空气受热膨胀,反应放出的热量使U型管内侧的液面立即下降,外侧的液面上升。利用这个装置还可以观察无水CuSO4水合时的放热现象。2.利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程(1)按图2-7所示将实验装置连接好。(2)向其中一个烧杯的水中投入一定量的CaO固体,CaO与水反应放热,此烧杯中的NO2平衡混合气体的红棕色变深。查找资料:NO2平衡气体遇热颜色加深,遇冷颜色变浅的反应原理。【实验探究3】利用原电池装置探究金属活动性方法一:[原理]活泼性不同的金属跟碳棒一起构成原电池时,用活泼金属做电极的电池电势差大,经放电后使灵敏导电仪(可以自制)中较多的小灯泡发光。[装置]图2-8利用原电池探究金属的活动性(一)[操作]1.按上图装配好仪器,小烧杯里各加10mL0.5mol/L的稀盐酸。2.接通电源,碳棒作为原电池的正极,镁条、铝条和铜条作负极,依次跟导电仪的两根电极接通,并浸入电解质溶液中。3.导线接触镁条时,反应最激烈,小灯泡全亮;导线接触铝条时,小灯泡只亮一半;导线接触铜条时,只有一支小灯泡微亮。[实验要点]装置的输入端正极接金属,负极接碳棒。实验前必须调节导电仪的灵敏度,使两根电极短路接触时灯泡不亮。方法二:[原理]1.原电池的电动势是正极跟负极的电势差(ε=E+-E-)。在三个原电池中,正极都是铜电极,因此负极的电势愈低,原电池的电动势愈大。2.电极的电势高低跟金属的活泼性有关。在盐溶液浓度相同的情况下,金属愈活泼,构成电极的电势愈低。[装置](二)[操作]1.如图2-9所示安装好装置。2.取4支5mm×80mm的玻璃管,管的一端套上玻璃纸,并用线扎紧。3.取长100mm的丝状或条状铜、铁、锌、镁各一段,分别插入上述四支玻璃管中,然后分别加入适量的0.5mol/L相应的金属盐溶液。这样就构成铜、铁、锌和镁的四支电极。4.在150mL的烧杯中加入100mL、1mol/L的KNO3溶液。在这溶液中任意插入两支电极,都能构成一个原电池。5.把铜电极分别跟另外三个电极构成原电池,用伏特计测量三个原电池的电动势。[实验要点]选用量程为2V的伏特计。【实验探究4】水果、蔬菜、果汁原电池的制作[活动目的]1.培养学生动手制作的能力。2.巩固学生已有的原电池知识。3.调动学生的学习兴趣,训练学生的创新思维。[活动形式]学生分组在课外自己选材制作。[成果展示]将自己的制作成果在...