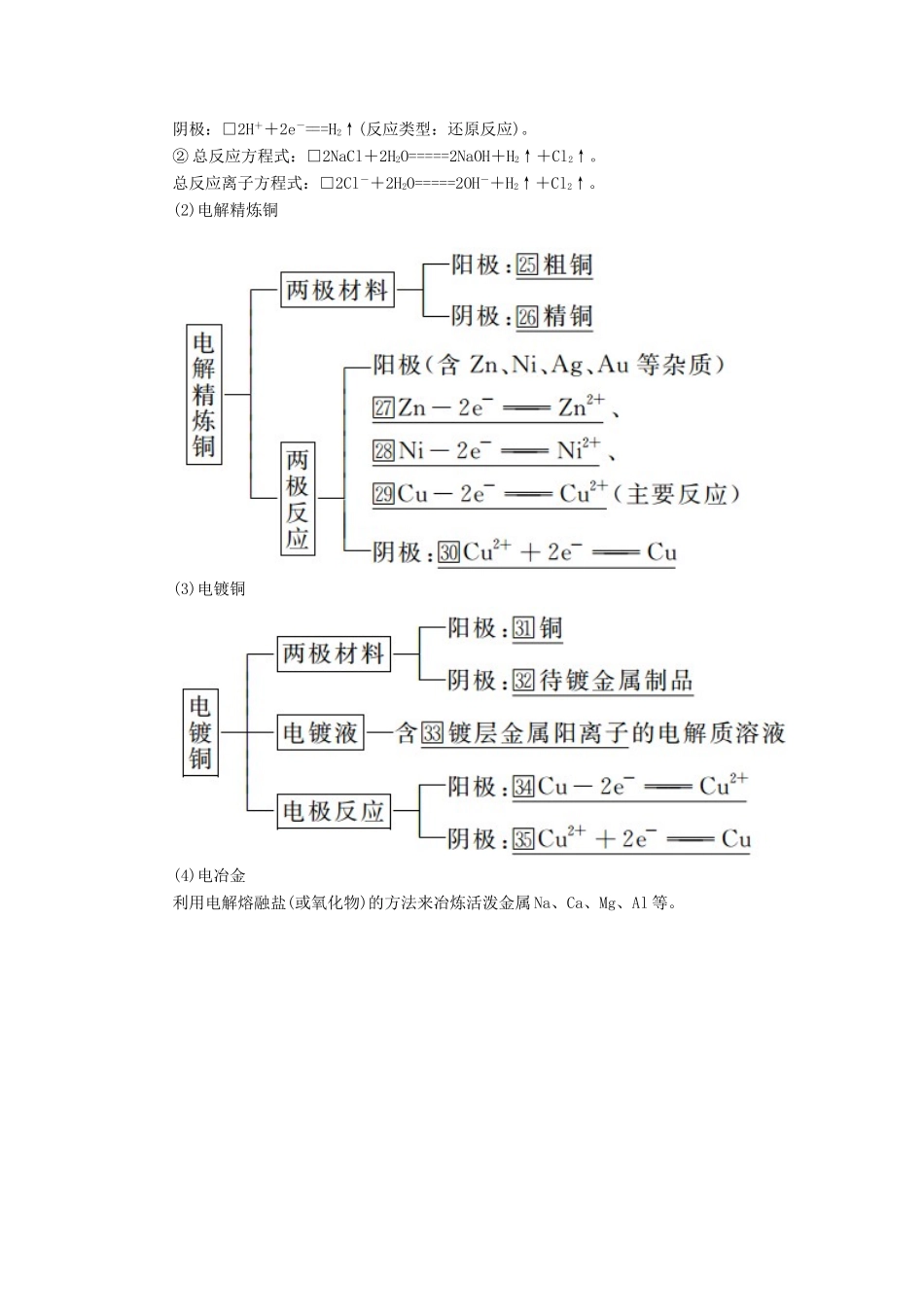
第29讲电解池金属的腐蚀和防护1.电解池(1)定义:电解池是把□电能转变为□化学能的装置。(2)电解池的构成条件①有外接直流电源。②有与□电源相连的两个电极。③形成闭合回路。④电解质溶液或□熔融电解质。(3)电解池工作原理(以电解CuCl2溶液为例)①电解原理示意图②阴阳两极上放电顺序a.阴极:(与电极材料无关)。□氧化性强的先放电,放电顺序:b.阳极:若是活性电极作阳极,则活性电极首先失电子,发生氧化反应。若是惰性电极作阳极,放电顺序为2.电解原理的应用(1)氯碱工业①电极反应阳极:□2Cl--2e-===Cl2↑(反应类型:氧化反应),阴极:□2H++2e-===H2↑(反应类型:还原反应)。②总反应方程式:□2NaCl+2H2O=====2NaOH+H2↑+Cl2↑。总反应离子方程式:□2Cl-+2H2O=====2OH-+H2↑+Cl2↑。(2)电解精炼铜(3)电镀铜(4)电冶金利用电解熔融盐(或氧化物)的方法来冶炼活泼金属Na、Ca、Mg、Al等。3.金属的腐蚀和防护(1)金属腐蚀的本质金属原子失去电子变成□金属阳离子,金属发生氧化反应。(2)金属腐蚀的类型①化学腐蚀与电化学腐蚀②析氢腐蚀与吸氧腐蚀以钢铁的腐蚀为例进行分析:铁锈的形成:2Fe+O2+2H2O===2Fe(OH)2,4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3+(x-3)H2O===Fe2O3·xH2O(铁锈)。(3)金属的防护1.判断正误,正确的画“√”,错误的画“×”,并指明错因。(1)电解质溶液的导电过程就是电解质溶液被电解的过程。(√)错因:_____________________________________________________________(2)电解CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色。(×)错因:电解CuCl2溶液时,阴极生成Cu。(3)电解盐酸、硫酸等溶液,H+放电,溶液的pH逐渐增大。(×)错因:电解H2SO4溶液是电解水,c(H+)增大,pH减小。(4)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变。(×)错因:电解精炼铜时,电解质溶液中c(Cu2+)减小。(5)用惰性电极电解饱和食盐水一段时间后,加入盐酸可使电解质溶液恢复到电解前的状态。(×)错因:电解饱和食盐水一段时间后,通入适量的HCl会恢复到电解前的状态,加盐酸会使溶液浓度变稀。(6)电解饱和食盐水时,两个电极均不能用金属材料。(×)错因:电解饱和食盐水时,可用金属材料。(7)在镀件上电镀铜时,镀件应连接电源的正极。(×)错因:镀件上镀铜时,镀件连接电源的负极。2.教材改编题(据人教选修四P88T6)下列说法不正确的是()A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比纯铁容易生锈C.铁质器件附有铜质配件,在接触处不易生铁锈D.用锡焊接的铁质器件,焊接处易生锈答案C考点电解原理及应用[典例1](2016·全国卷Ⅰ)三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是()A.通电后中间隔室的SO离子向阳极迁移,阳极区溶液pH增大B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品C.阴极反应为2H2O-4e-===O2+4H+,阴极区溶液pH降低D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成解析阳极区域水电离出的OH-放电,溶液中c(H+)增大,pH减小,中间隔室的SO透过cd膜移到阳极区可得产品H2SO4;阴极区水电离出的H+放电:2H++2e-===H2↑,溶液中c(OH-)增大,溶液pH增大,中间隔室的Na+透过ab膜移入阴极区,可得产品NaOH;由得失电子守恒,结合电极反应4OH--4e-===2H2O+O2↑可知,通过1mole-会有0.25molO2产生。答案B名师精讲1.以惰性电极电解电解质溶液的规律2.电极反应式的书写步骤与方法3.电解原理应用的注意事项(1)阳离子交换膜(以电解NaCl溶液为例),只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和分子(Cl2)通过,这样既能防止H2和Cl2混合发生爆炸,又能避免Cl2和NaOH溶液作用生成NaClO影响烧碱的质量。(2)电解或电镀时,电极质量减少的电极必为金属电极——阳极;电极质量增加的电极必为阴极,即溶液中的金属阳离子得电子变成金属吸附在阴极上。(3)电解精炼铜,粗铜中含有的Zn、Fe、Ni等活泼金属失去电子,变成...