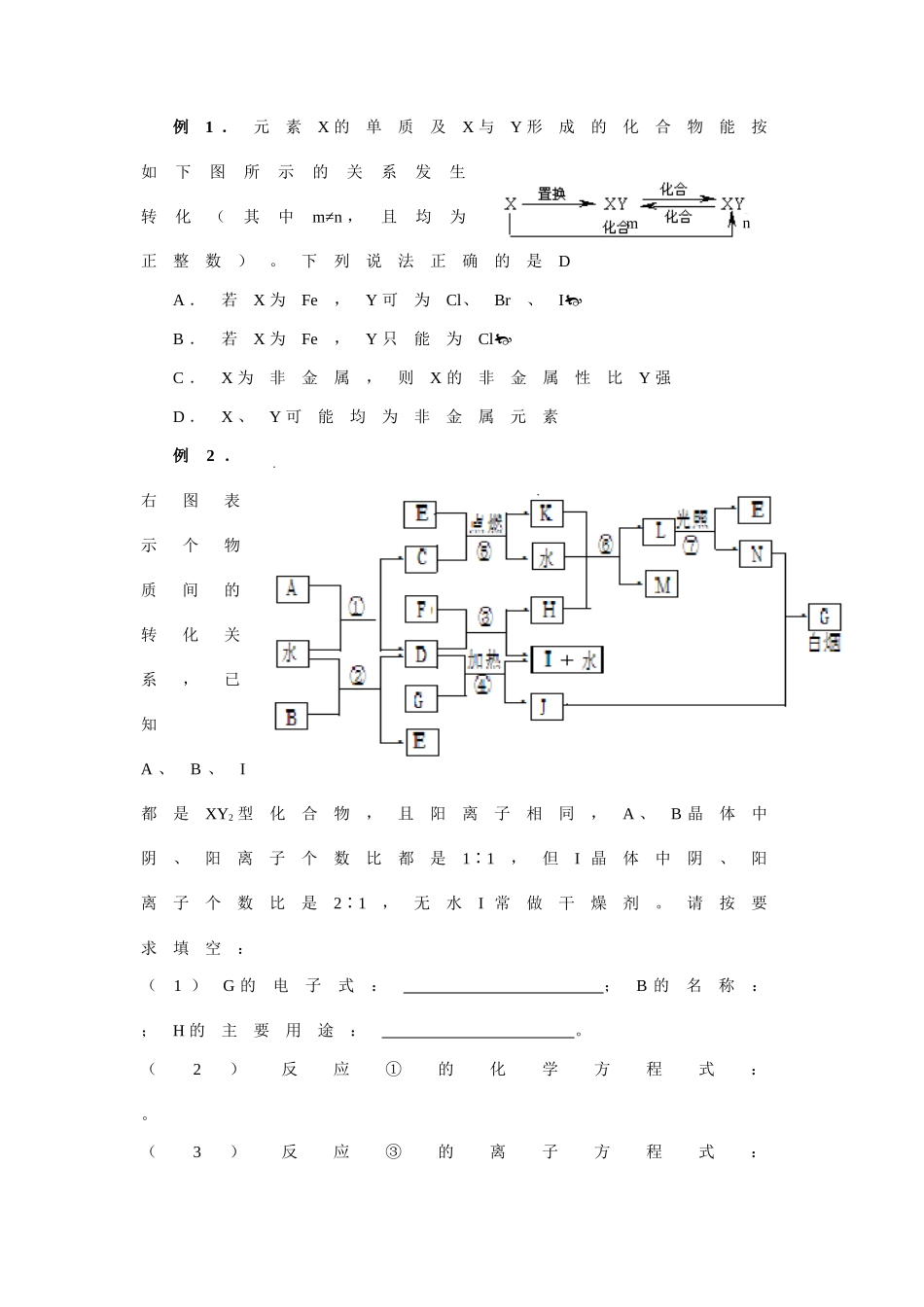
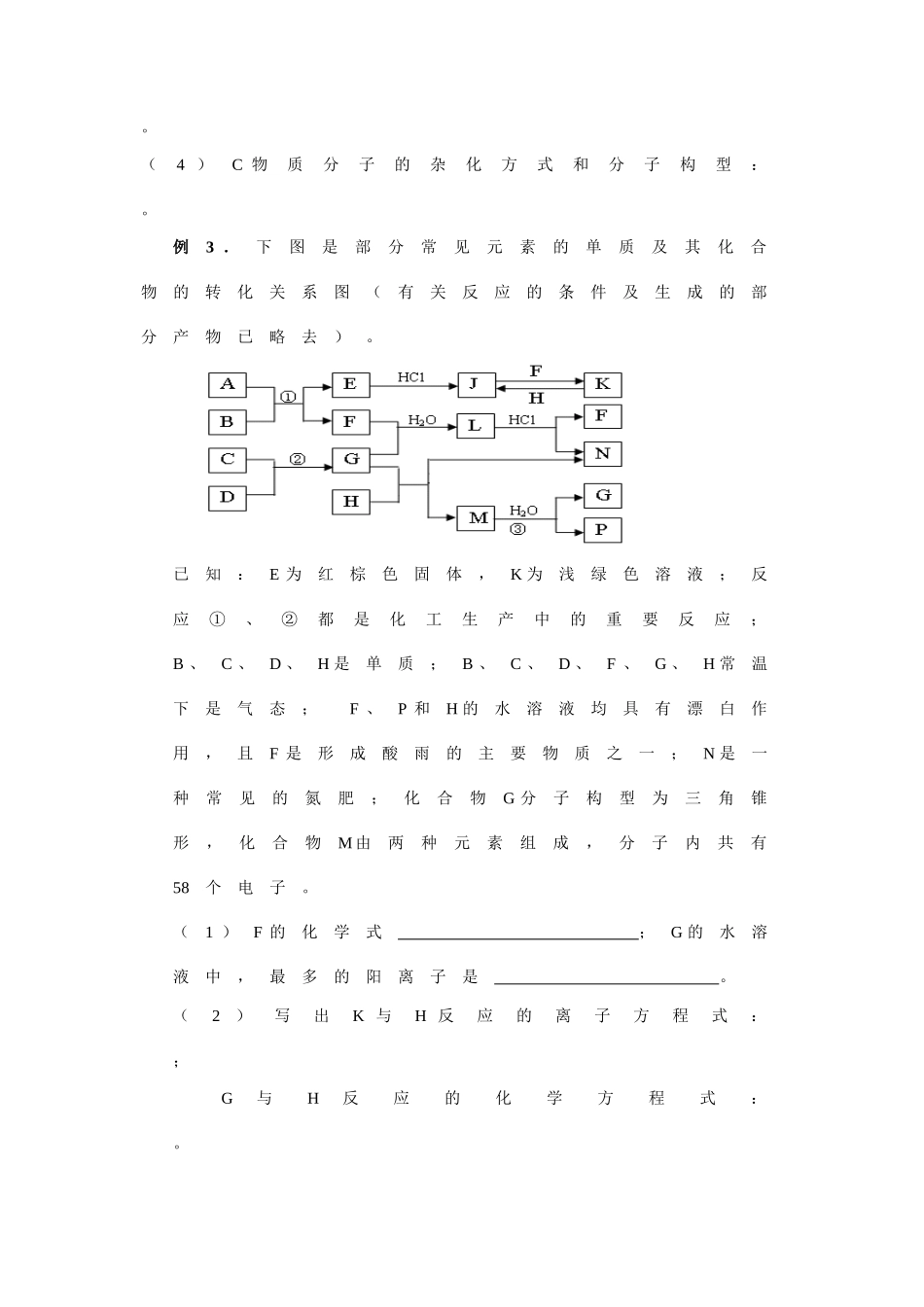
深挖细掘审题专题十四无机物推断灌云高级中学陈克志顾辉邱建业【考纲要求】1.了解常见不同类型化合物之间转化的条件和方法。2.能综合应用常见金属和非金属元素单质及其化合物的主要性质。3.能依据所提供的资料或信息,获取并归纳元素化合物的性质。【知识网络】1.物质的特有颜色2.特征反应现象3.特征转化关系4.特殊反应条件5.重要工业生产反应6.特征数据(反应物物质的量比、相对分子质量、化合物中各元素的含量、化合物中离子个数比、电子总数、质子总数、化合价、放出气体的体积或生成沉淀的量等。)整体思路为:原题材(包括框图有关信息)找已知条件(明显条件,隐性条件)找特殊(反应,性质,结构)得出相应的结论。解题的关键是迅速找出突破口,然后以突破口为中心,选择适宜的方法,得出结论。做到“大胆假设,小心验证”。【典型例题】抓关键推断(顺推,逆推,假设论证)例1.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是DA.若X为Fe,Y可为Cl、Br、IB.若X为Fe,Y只能为ClC.X为非金属,则X的非金属性比Y强D.X、Y可能均为非金属元素例2.右图表示个物质间的转化关系,已知A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,无水I常做干燥剂。请按要求填空:(1)G的电子式:;B的名称:;H的主要用途:。(2)反应①的化学方程式:。(3)反应③的离子方程式:mn。(4)C物质分子的杂化方式和分子构型:。例3.下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态;F、P和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。(1)F的化学式;G的水溶液中,最多的阳离子是。(2)写出K与H反应的离子方程式:;G与H反应的化学方程式:。(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释。例4.短周期元素形成的纯净物A、B、C、D、E转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。请回答下列问题:(1)若C是离子化合物,D是一种强碱,写出C的化学式。(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。。②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系。(3)若C是一种气体,D是一种强酸,则:①C与水反应的化学方程式为。②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用右图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是。③已知常温下物质A与物质B生成1mol气体C的焓变为-57kJ/mol,1mol气体C与H2O反应生成D溶液和E气体的焓变为-46kJ/mol,写出物质A与物质B及水生成D溶液的热化学方程式。【针对性练习】1.A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体。D、E、F、G、X均为化合物,G在常温下为液态。它们之间的转化关系如下图所示(其中某些反应条件和部分反应产物已略去)。(1)D的化学式;(2)在反应①—⑥中,不属于氧化还原反应的是(填编号)。(3)往F溶液中加入NaOH溶液观察到的现象是。(4)已知反应⑥中消耗9g气态G放出aKJ的热量,试写出该反应的热化学方程式:;该反应中每消耗0.6mol的A,可转移电子mol。(5)写出下列反应的离子方程式:D的水溶液与小苏打溶液混合。向含有3molF的溶液中通入4molCl2的离子反应方程式为。2.下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。(1)写出化学式A,D,F,写出电子...