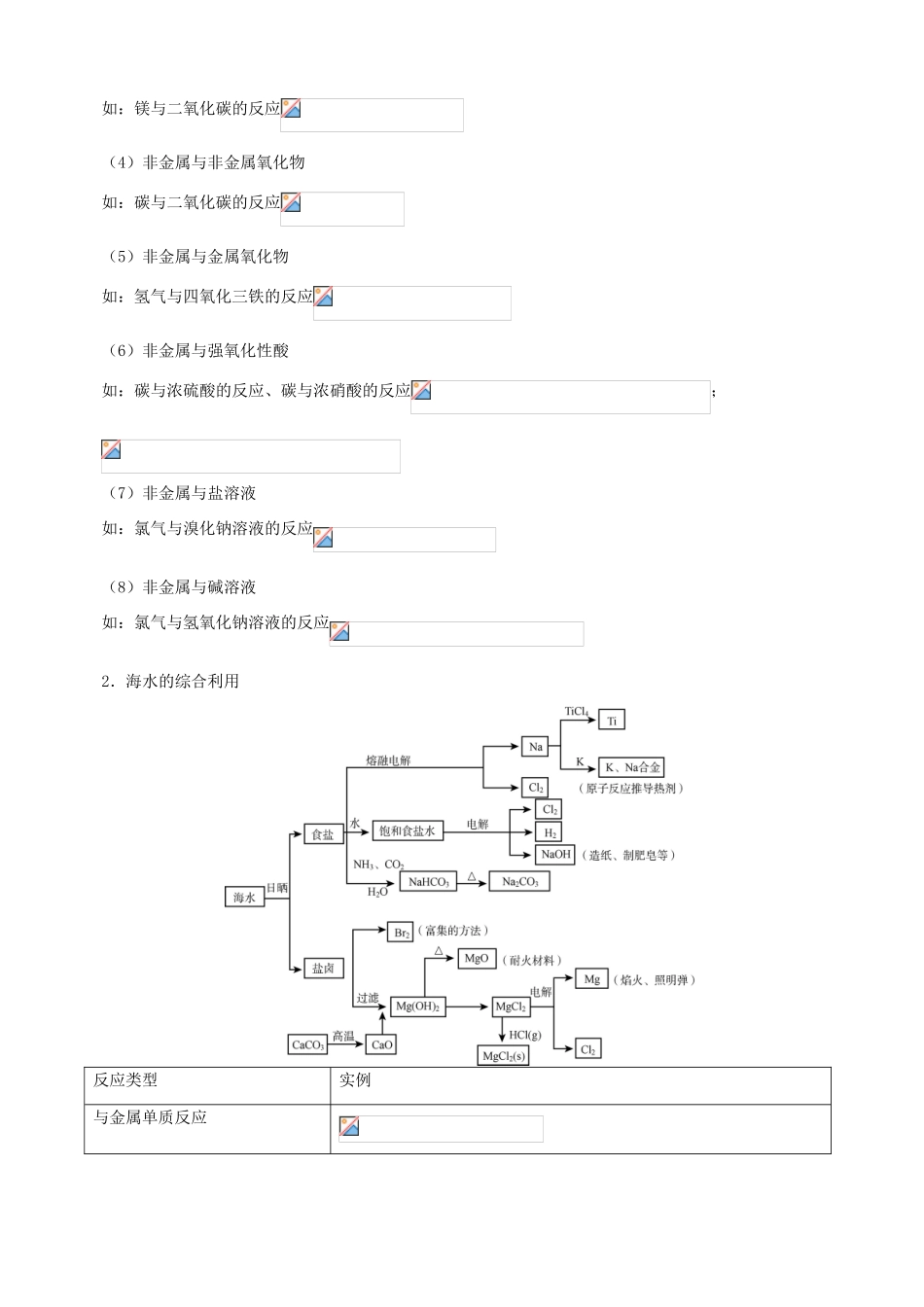
专题三常见无机物综合知识点《高考考试说明》对应教科书内容常见无机物及其应用结合海水、金属矿物等自然资源综合利用的实例,了解运用物质性质和反应规律能实现物质间的转化认识化学在环境监测与保护中的重要作用以上各部分知识的综合应用《模块学习要求》金属的学习方法通过对钠、铝、铁及其化合物之间转化关系的比较和归纳,逐步体会学习元素化合物知识的一般方法必修l第三章第一节、第二节、第三节金属元素与非金属元素的综合——海水、金属矿物等自然资源的综合利用以海水、金属矿物等自然资源的综合利用为例,了解化学方法在实现物质间转化中的作用;认识化学在自然资源综合利用方面的重要价值;以具体实例体会如何利用化学反应制备新物质,从而认识到化学反应在制造新物质方面的作用,以及新物质的合成对人类生活的影响必修2第四章第一节第二节一、知识整理1.各类无机物间的转化关系按类别掌握物质的性质是化学学科学习的重要特点,各类物质间相互反应、相互转化的规律可用如下关系图来归纳:图中包括纵向的两条物质之间的衍变线和各类物质之间的相互反应线,这些线反映了物质间反应与转化的规律。这里强调的是:第一要看到物质的类别属性;第二更应该看到含有相同元素的物质之间的相互转化关系:第三还要注意规律的适用范围。例如,金属与酸反应在高中阶段的扩展表现为与氧化性酸的反应。(1)活泼金属与氧化性酸反应不产生氢气。(2)常温下,铁、铝与浓硫酸、浓硝酸发生钝化。(3)不活泼金属可与氧化性酸反应。例如:(4)金属与氧化性酸反应时酸的浓度不同产物不同。如:第四还要注意拓展。高中学习中新增的一些反应主要是对金属单质、非金属单质性质的进一步发展。(1)金属与金属氧化物如:铝与氧化铁的反应(2)金属与碱溶液如:铝与氢氧化钠溶液的反应(3)金属与非金属氧化物如:镁与二氧化碳的反应(4)非金属与非金属氧化物如:碳与二氧化碳的反应(5)非金属与金属氧化物如:氢气与四氧化三铁的反应(6)非金属与强氧化性酸如:碳与浓硫酸的反应、碳与浓硝酸的反应;(7)非金属与盐溶液如:氯气与溴化钠溶液的反应(8)非金属与碱溶液如:氯气与氢氧化钠溶液的反应2.海水的综合利用反应类型实例与金属单质反应与非金属单质反应分解反应(电解)与化合物反应水化水合盐水解其它有机反应加成反应水解反应二、重点知识解析无机推断题是高考化学的重要考查形式,此类试题具有较高的综合度。解题时需依据相关物质的性质和反应规律,同时相关物质的重要特征和反应特征又是解题突破的依据,因此在复习中应特别注注重要物质的特征性质和特征反应。1.特征的颜色(1)固体黄色:、浅黄色:、。红色:、(紫红色)、(红棕色)。黑色:、、(石墨)、、、(黑色晶体)。紫黑色:、(2)溶液蓝色、紫红色、浅绿色、棕黄色、红色、氯水浅黄绿色、溴水橙黄色、碘水棕黄色。(3)气体黄绿色、红棕色、蒸气红棕色、蒸气紫色。2.特征的焰色钠的焰色为黄色、钾的焰色为紫色(通过蓝色钴玻璃)。3.特征的状态、气味常温呈液态的金属单质:;呈液态的非金属单质:。常温呈气态的单质:、、、、、稀有气体。刺激性气味的气体:、、、、。4.特征的实验现象(1)遇酚酞变红色或使湿润的红色石蕊试纸变蓝的气体:。(2)无色气体遇空气变为红棕色:。(3)与反应生成淡黄色沉淀的气体有:、、、。(4)遇到淀粉碘化钾试纸变蓝的气体有:、、蒸气、蒸气。(5)电解时阳极产生的气体一般是:、,阴极产生的气体是:。(6)能使品红溶液褪色的气体可能是:、,加热恢复原颜色的是,不恢复的是,能使品红溶液褪色的物质可能有:氯水、、过氧化钠、活性炭。(7)遇生成沉淀,可能是:、、。(8)遇生成沉淀,可能是:、;。(9)遇生成不溶于硝酸的白色沉淀,可能是:、、。(10)加碱产生白色沉淀,迅速变成灰绿色,最终变成红褐色:。(11)加苯酚显紫色或加显红色或加碱产生红褐色沉淀:。(12)遇淀粉变蓝的:碘单质。5.特征的反应(1)与碱反应产生气体单质:铝与氢氧化钠溶液反应产生氢气。化合物:铵盐与碱加热反应产生氨气。(2)既能与酸反应,又能与碱反应、、、弱酸的酸...