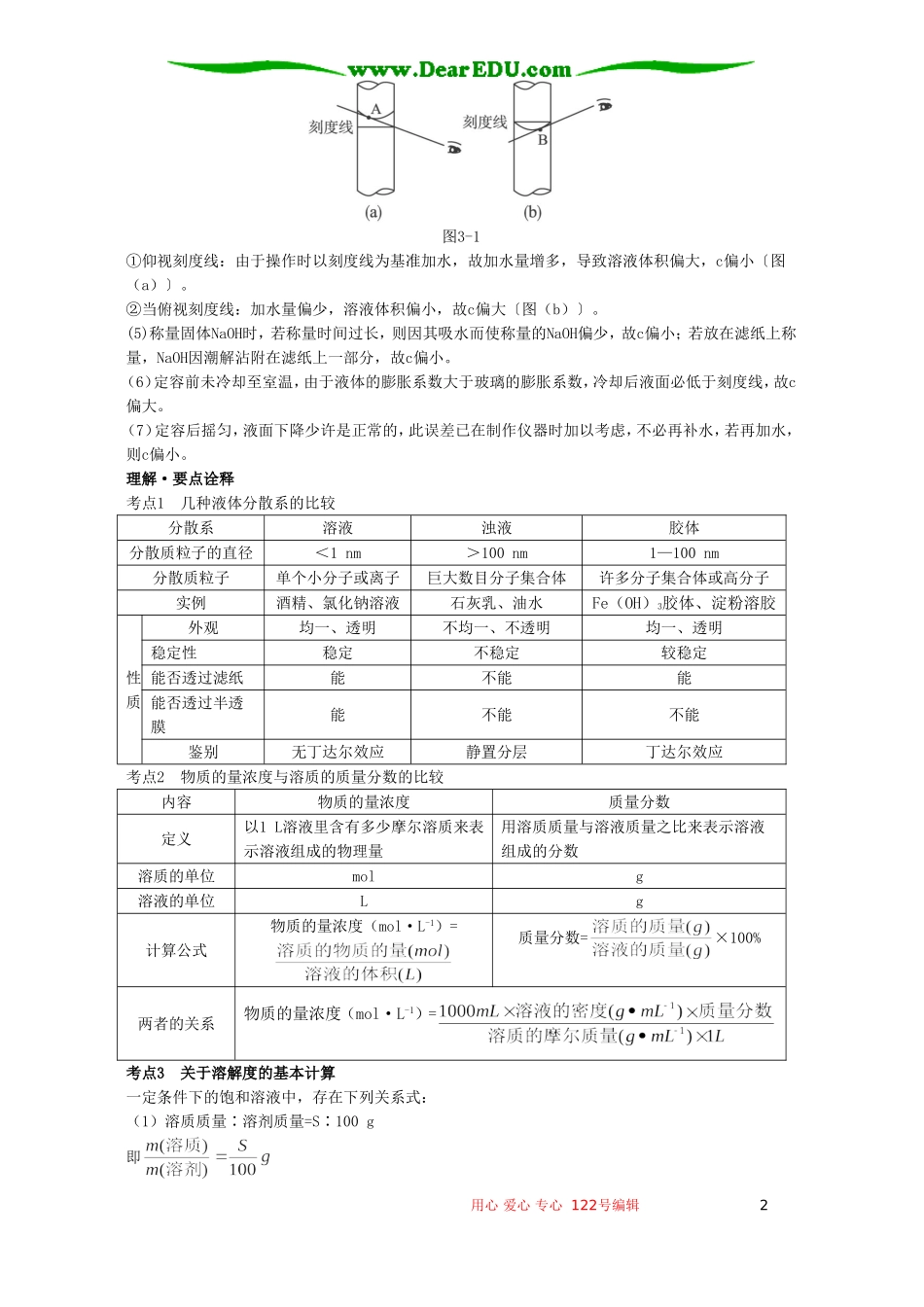
高考化学母题实战应考指南第二轮复习第三章物质的量2二、溶液与胶体巩固·夯实基础●网络构建●自学感悟1.溶液的物质的量浓度某温度下,将Wg氢氧化钠溶于水,得到VmL饱和溶液,其密度为bg·mL-1。(1)该温度下氢氧化钠的溶解度为g;氢氧化钠溶液的物质的量浓度为mol·L-1;溶质氢氧化钠的质量分数为×100%。(2)若取该氢氧化钠饱和溶液mL,其物质的量浓度为mol·L-1;所含氢氧化钠的物质的量为mol;若将其加水稀释至VmL后,溶液的物质的量浓度为mol·L-1。2.胶体的重要性质及应用(1)将饱和三氯化铁溶液滴入沸水时,液体变为红褐色,得到的是Fe(OH)3胶体;反应的离子方程式为Fe3++3H2O△Fe(OH)3(胶体)+3H+;用此分散系进行实验:将其装入U形管内,用石墨作电极,接通直流电源,通电一段时间后发现阴极附近颜色逐渐变深,这表明Fe(OH)3胶粒带正电荷,这种现象称为电泳。(2)把10mL淀粉胶体和5mLKI溶液的混合液体加入到用半透膜制成的袋内,将此袋浸入蒸馏水中。2min后,用两支试管各取5mL烧杯中的液体,并做如下实验:①向其中一支试管里滴加少量AgNO3溶液,其现象是出现黄色沉淀。②向另一支试管里滴加少量碘水,其现象是无明显变化。③由上述实验得出的结论是I-能透过半透膜,淀粉胶体不能透过半透膜。(3)分别设计化学实验用最佳方法证明明矾溶于水时发生的下列变化(供选用的药品和仪器:明矾溶液、甲基橙试液、石蕊试液、酚酞试液、pH试纸、氢氧化钠溶液、酒精灯、半透膜、电泳仪、聚光束仪):①证明明矾发生了水解反应:用pH试纸测明矾溶液的pH,pH<7,证明溶液呈酸性。②证明其水解反应是一个吸热反应:加热溶液,用pH试纸测溶液的pH,pH减小。③证明生成了胶体溶液:用聚光束仪的光束照溶液,有丁达尔效应。链接·拓展物质的量浓度溶液配制误差分析根据c=判断:(1)若称量固体溶质时,操作无误,但所用砝码生锈,m偏大,结果偏高。(2)若没有洗涤烧杯内壁或引流用的玻璃棒,使n减小,结果偏低。(3)若容量瓶中有少量蒸馏水或定容后反复摇匀发现液面低于刻度,则对结果无影响。(4)俯视、仰视对结果的影响(如图31)用心爱心专心122号编辑1图3-1①仰视刻度线:由于操作时以刻度线为基准加水,故加水量增多,导致溶液体积偏大,c偏小〔图(a)〕。②当俯视刻度线:加水量偏少,溶液体积偏小,故c偏大〔图(b)〕。(5)称量固体NaOH时,若称量时间过长,则因其吸水而使称量的NaOH偏少,故c偏小;若放在滤纸上称量,NaOH因潮解沾附在滤纸上一部分,故c偏小。(6)定容前未冷却至室温,由于液体的膨胀系数大于玻璃的膨胀系数,冷却后液面必低于刻度线,故c偏大。(7)定容后摇匀,液面下降少许是正常的,此误差已在制作仪器时加以考虑,不必再补水,若再加水,则c偏小。理解·要点诠释考点1几种液体分散系的比较分散系溶液浊液胶体分散质粒子的直径<1nm>100nm1—100nm分散质粒子单个小分子或离子巨大数目分子集合体许多分子集合体或高分子实例酒精、氯化钠溶液石灰乳、油水Fe(OH)3胶体、淀粉溶胶性质外观均一、透明不均一、不透明均一、透明稳定性稳定不稳定较稳定能否透过滤纸能不能能能否透过半透膜能不能不能鉴别无丁达尔效应静置分层丁达尔效应考点2物质的量浓度与溶质的质量分数的比较内容物质的量浓度质量分数定义以1L溶液里含有多少摩尔溶质来表示溶液组成的物理量用溶质质量与溶液质量之比来表示溶液组成的分数溶质的单位molg溶液的单位Lg计算公式物质的量浓度(mol·L-1)=质量分数=×100%两者的关系物质的量浓度(mol·L-1)=考点3关于溶解度的基本计算一定条件下的饱和溶液中,存在下列关系式:(1)溶质质量∶溶剂质量=S∶100g即用心爱心专心122号编辑2(2)溶质质量:饱和溶液质量=S∶(100g+S)即难点溶液浓度的计算与换算(1)溶液稀释定律①对于已知质量分数溶液的稀释:溶质的质量稀释前后不变,即m1·w1=m2·w2。②对于已知物质的量浓度溶液的稀释:溶质的物质的量稀释前后不变,即c1V1=c2V2。(2)物质的量浓度与溶质质量分数的换算n=c=。(3)溶解度与溶质质量分数w的换算w=×100%S=。(4)溶解度与物质的量浓度的换算c=(ρ的单位为g...