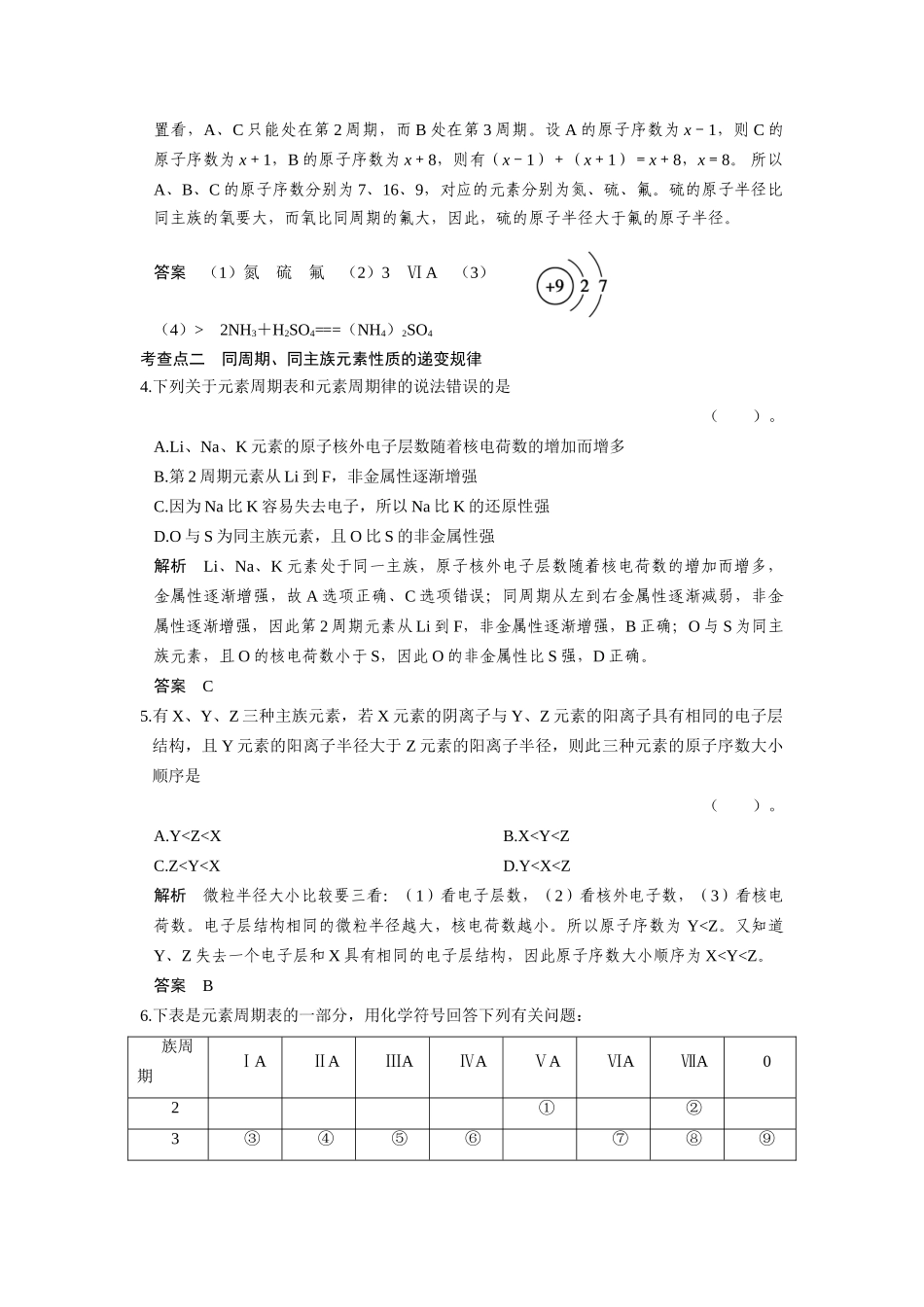
第三课时元素周期表及其应用(时间:30分钟)考查点一元素周期表的结构1.下列有关元素周期表的叙述正确的是()。A.有16个族,就是有16个纵行B.所含元素种类最多的族为第Ⅷ族C.金属元素的种类多于非金属D.第n周期第n主族的元素均为金属解析周期表中16个族,18个纵行;所含元素种类最多的族为第ⅢB族,第1周期第ⅠA族为非金属。答案C2.下列叙述正确的是()。A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B.除短周期外,其他周期均为18种元素C.副族元素没有非金属元素D.碱金属元素是指ⅠA族的所有的元素解析选项A中,F和O元素一般只有负价,没有正价;选项B,第六周期为32种元素,如果第七周期填满也为32种元素;选项D,第ⅠA族元素包括H,H不是碱金属元素。答案C3.A、B、C为短周期元素,在周期表中所处位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。(1)写出A、B、C三种元素的名称、、。(2)B位于元素周期表第周期,第族。(3)C的原子结构示意图为_________________。(4)比较B、C的原子半径,BC,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式。解析本题考查根据元素在元素周期表中的位置推断元素,再根据元素在周期表中的位置分析元素性质的递变规律。依据题意A、B、C为短周期元素,从A、B、C的相对位置看,A、C只能处在第2周期,而B处在第3周期。设A的原子序数为x-1,则C的原子序数为x+1,B的原子序数为x+8,则有(x-1)+(x+1)=x+8,x=8。所以A、B、C的原子序数分别为7、16、9,对应的元素分别为氮、硫、氟。硫的原子半径比同主族的氧要大,而氧比同周期的氟大,因此,硫的原子半径大于氟的原子半径。答案(1)氮硫氟(2)3ⅥA(3)(4)>2NH3+H2SO4===(NH4)2SO4考查点二同周期、同主族元素性质的递变规律4.下列关于元素周期表和元素周期律的说法错误的是()。A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多B.第2周期元素从Li到F,非金属性逐渐增强C.因为Na比K容易失去电子,所以Na比K的还原性强D.O与S为同主族元素,且O比S的非金属性强解析Li、Na、K元素处于同一主族,原子核外电子层数随着核电荷数的增加而增多,金属性逐渐增强,故A选项正确、C选项错误;同周期从左到右金属性逐渐减弱,非金属性逐渐增强,因此第2周期元素从Li到F,非金属性逐渐增强,B正确;O与S为同主族元素,且O的核电荷数小于S,因此O的非金属性比S强,D正确。答案C5.有X、Y、Z三种主族元素,若X元素的阴离子与Y、Z元素的阳离子具有相同的电子层结构,且Y元素的阳离子半径大于Z元素的阳离子半径,则此三种元素的原子序数大小顺序是()。A.Y