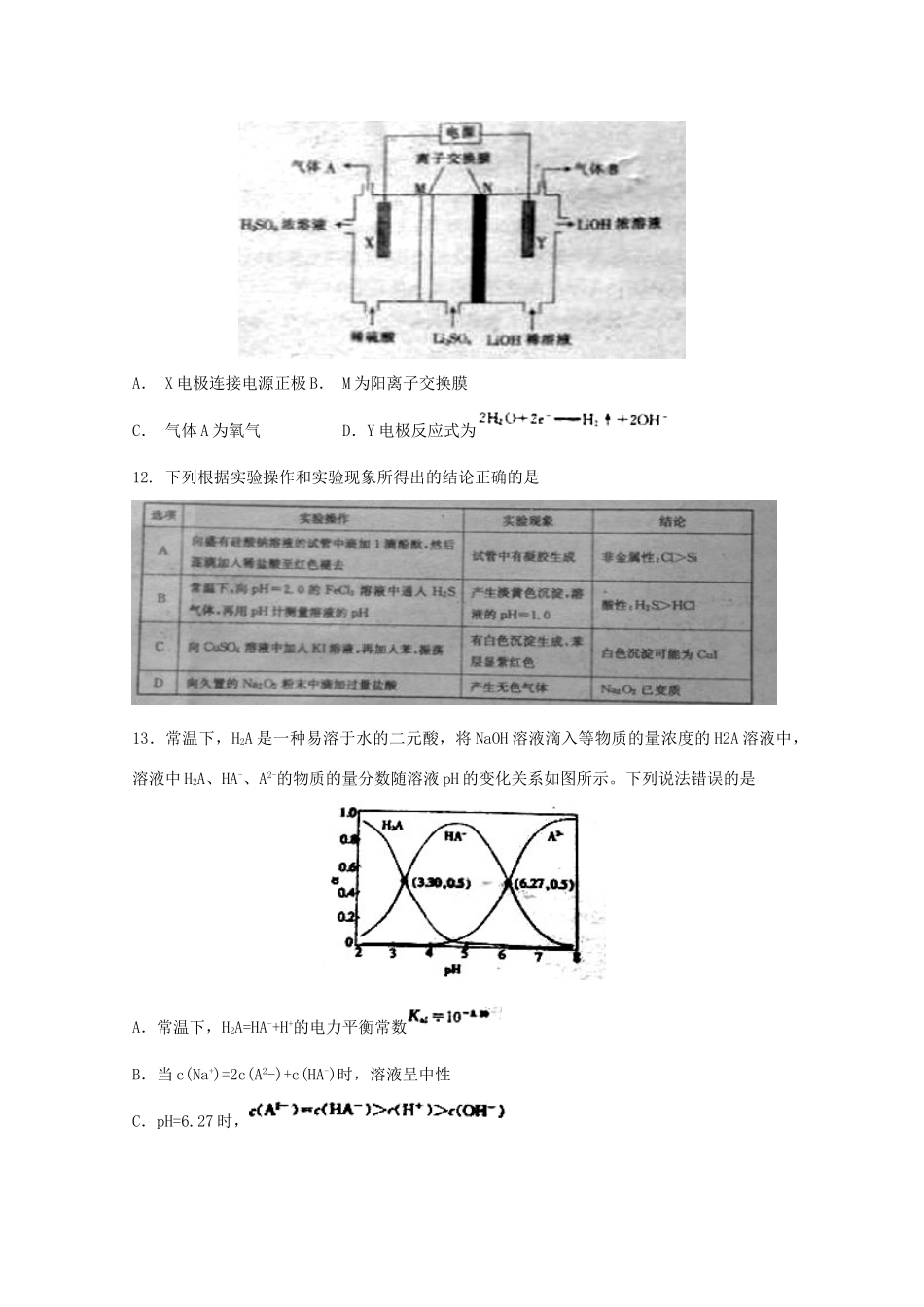
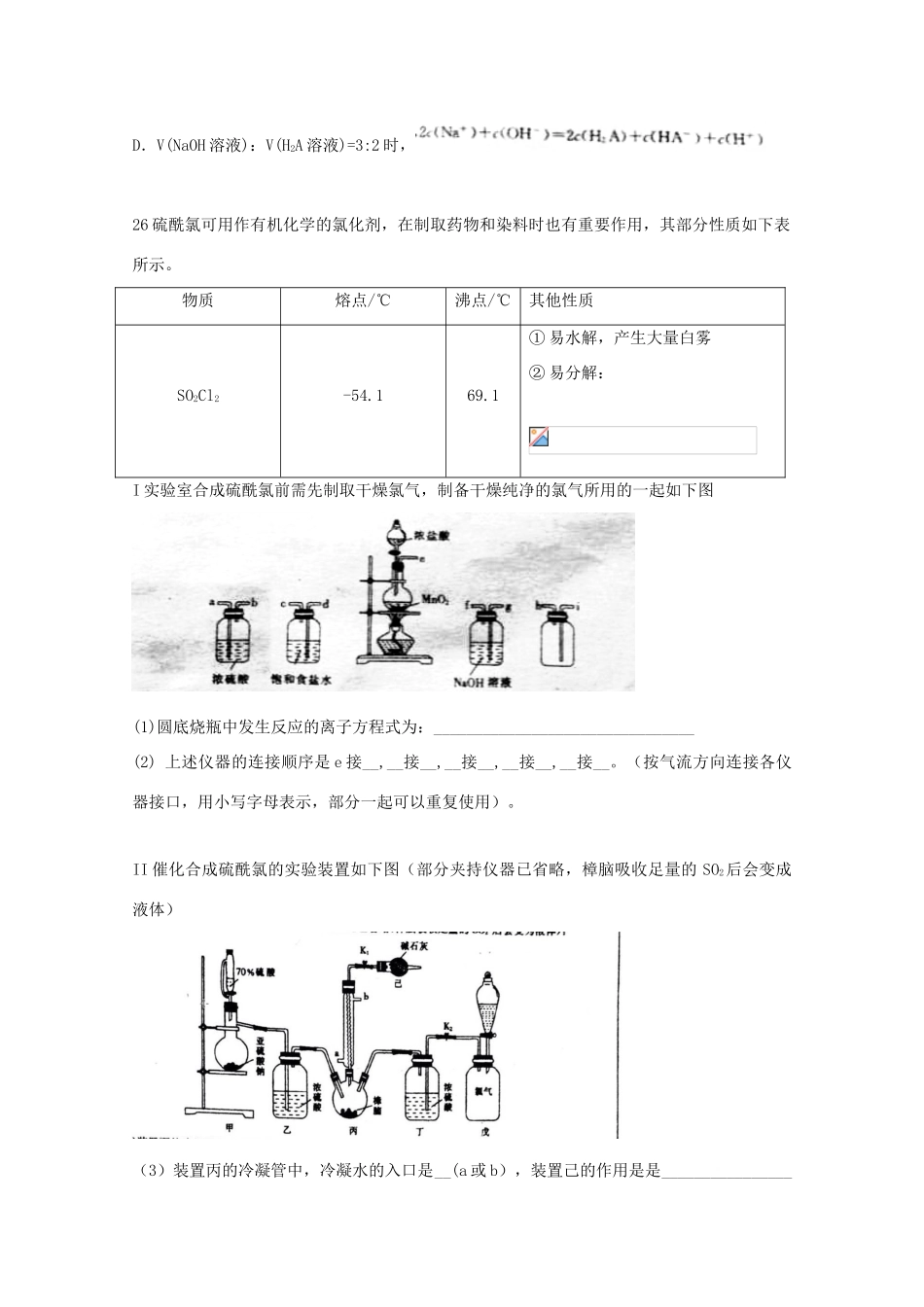
广东省2018届高三理综(化学部分)第一次模拟考试试题7.《梦溪笔谈》中记载:“信州铅山县有苦泉,流之为涧,挹其水熬之,则成胆矾……熬胆矾铁釜,久之亦化为铜。”文中涉及的化学反应类型有A.复分解反应B.置换反应C.取代反应D.加成反应8.化学在生活中有广泛的应用,下列物质的性质与应用相对应的是9.短周期元素W、X、Y、Z的原子序数依次增太.W的单质是空气的主要成分之一,常用作粮食的保护期,Y是同周期所有元素中原子半径最小的元素,Z的最外层电数等于其最内层电子数.下列说法正确的是A.元素的非金属性:Y>X>WB.WX与ZX中的化学键类型相同C.简单离子的半径:Z>Y>XD.Y的氢化物的水溶液可使红色石蕊试纸变蓝10.已知互为同分异构体,下列说法不正确的是A.盆烯可与酸性高锰酸钾溶液反应B.苯与棱晶烷的一氯代物均只有一种C.上述三种物质中,与甲苯互为同系物的只有苯D.上述三种物质中,只有棱晶烷的所有原子不处于同一平面内11.用氢氧化锂生产锂基润滑脂可用作宇航设备的润滑剂,清华大学首创三室膜电解法制备LiOH,其工作原理如图所示,下列说法不正确的是A.X电极连接电源正极B.M为阳离子交换膜C.气体A为氧气D.Y电极反应式为12.下列根据实验操作和实验现象所得出的结论正确的是13.常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数随溶液pH的变化关系如图所示。下列说法错误的是A.常温下,H2A=HA-+H+的电力平衡常数B.当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性C.pH=6.27时,D.V(NaOH溶液):V(H2A溶液)=3:2时,26硫酰氯可用作有机化学的氯化剂,在制取药物和染料时也有重要作用,其部分性质如下表所示。物质熔点/℃沸点/℃其他性质SO2Cl2-54.169.1①易水解,产生大量白雾②易分解:I实验室合成硫酰氯前需先制取干燥氯气,制备干燥纯净的氯气所用的一起如下图(1)圆底烧瓶中发生反应的离子方程式为:________________________________(2)上述仪器的连接顺序是e接__,__接__,__接__,__接__,__接__。(按气流方向连接各仪器接口,用小写字母表示,部分一起可以重复使用)。II催化合成硫酰氯的实验装置如下图(部分夹持仪器已省略,樟脑吸收足量的SO2后会变成液体)(3)装置丙的冷凝管中,冷凝水的入口是__(a或b),装置己的作用是是_________________(4)装置戊的分液漏斗中最好选用的试剂是____A蒸馏水B饱和食盐水C氢氧化钠浓溶液D6mol/L碳酸氢钠溶液(5)装置甲和丁除了干燥气体外,还具有的作用是______________________.若缺少装置甲和丁,潮湿的氯气和二氧化硫反应的化学方程式是_________________________。(6)简述制备SO2Cl2的操作步骤_______________________________________27:合成氨厂和硝酸厂的烟气中含有大量的氮氧化物(NOx)脱硝通常是指将烟气中的氮氧化物转化为无毒无害的物质的化学过程。(1)选择性催化还原技术(SCR)是目前最成熟的脱硝技术,即在金属催化剂的作用下,用还原剂(如NH3)选择性的与NOx反应生成N2和H2O。已知:脱硝反应:的△H=________(2)将amolN2和3amolH2通入一密闭容器中在不同的温度和压强下发生反应:测得平衡体系中NH3的物质的量的分数如图所示。①下列可提高氨气产率的途径是__________。A:尽量提高反应温度;B:对原料气适当加压C:采用适当的催化剂;D:将氨气液化,不断移出液氨。②上图所示平衡体系中当NH3的物质的量分数分别为0.549和0.429时,该反应的平衡常数分别为K1和K2,则K1____K2(填写>,<或=)当NH3的物质的量分数为0.600时,容器的体积为2L,此时该反应的化学平衡常数K=____。(3)常温下,将NO和H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中其物质转化过程如图所示,①反应I中氧化剂与还原剂的物质的量之比为_______。②写出该过程的总化学反应方程式_____________________________________。(3)直接电解吸收也是脱硝的一种方法,先用6%的稀硝酸吸收NOx,会生成HNO2(一种一元弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,其电解装置如图所示。①:途中b应连接电源的____(正极或负极)②:阳极的电极反应式...