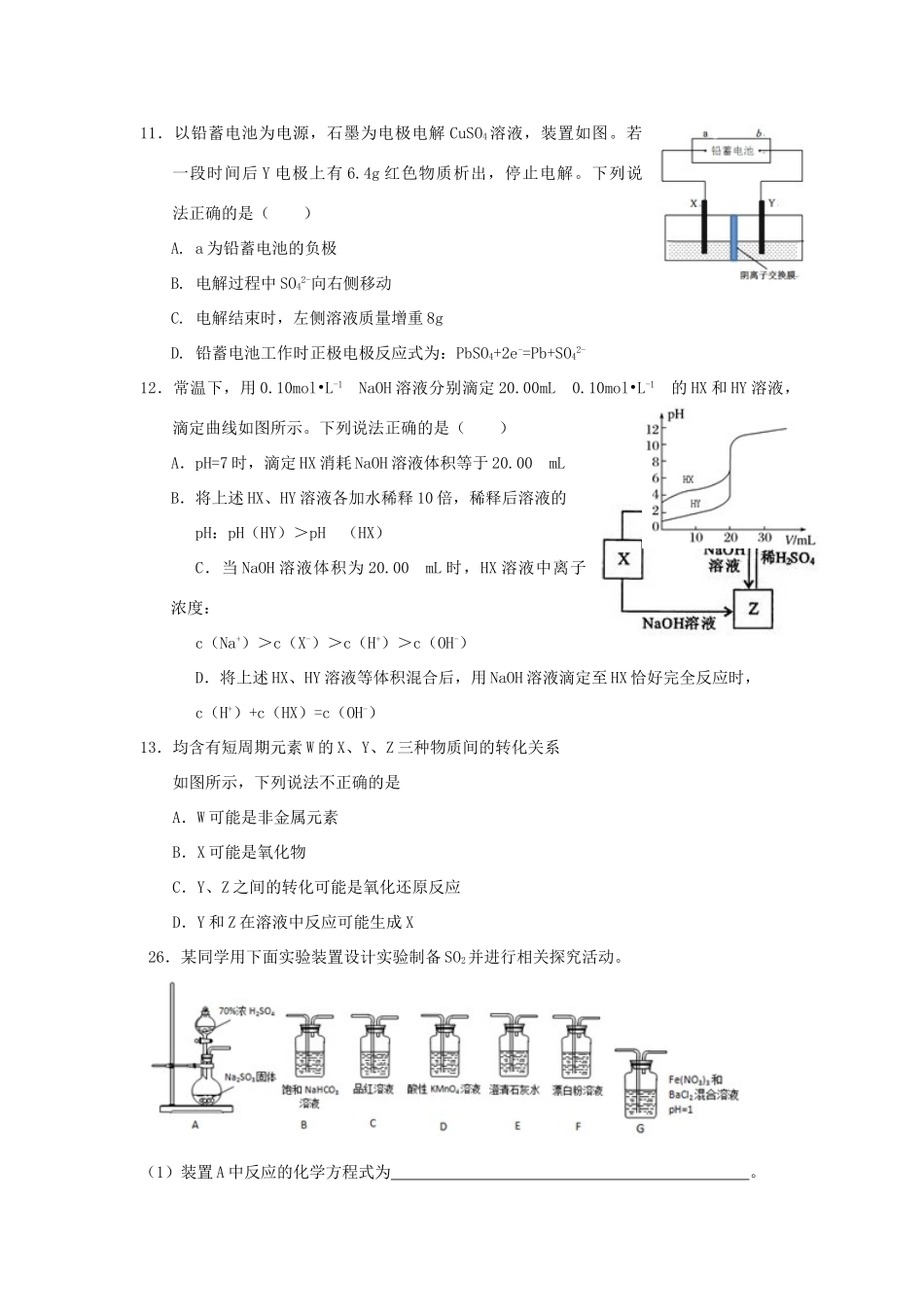
湖北省荆州市沙市区2018届高三化学上学期第六次双周考试题7.化学与社会、生产、生活密切相关。下列说法正确的是()A.生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生B.油脂是人类维持生命活动所需能量的主要来源C.PM2.5是指空气中氮氧化物和硫氧化物含量之和D.登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是()A.在标准状况下,22.4LC2H6中含共价键的数目为6NAB.5gKHCO3与CaCO3混合固体中阴离子数目为0.05NAC.常温下,1L0.1mol•L-1CH3COONa溶液中CH3COO-离子数目为0.1NAD.在Na2O2与H2O的反应中,当转移0.2NA个电子时生成的O2体积为2.24L9.下列有关有机化合物的说法正确的是()A.CH2=CHCH3分子中所有原子在一个平面上B.的同分异构体中,苯环上的一氯代物只有一种的结构有4种C.CH2=CHCH2OH能发生加成发应、取代反应、氧化反应等D.苯乙烯()能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4molBr210.关于下列实验装置叙述正确的是()A.B.装置可用于提纯胶体装置可用于排空气法收集气体,可收集CO2、NH3、H2等C.D.装置可用于吸收SO2装置可用验证浓硫酸具有强氧化性11.以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如图。若一段时间后Y电极上有6.4g红色物质析出,停止电解。下列说法正确的是()A.a为铅蓄电池的负极B.电解过程中SO42-向右侧移动C.电解结束时,左侧溶液质量增重8gD.铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-12.常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL0.10mol•L-1的HX和HY溶液,滴定曲线如图所示。下列说法正确的是()A.pH=7时,滴定HX消耗NaOH溶液体积等于20.00mLB.将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH(HX)C.当NaOH溶液体积为20.00mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-)D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-)13.均含有短周期元素W的X、Y、Z三种物质间的转化关系如图所示,下列说法不正确的是A.W可能是非金属元素B.X可能是氧化物C.Y、Z之间的转化可能是氧化还原反应D.Y和Z在溶液中反应可能生成X26.某同学用下面实验装置设计实验制备SO2并进行相关探究活动。(1)装置A中反应的化学方程式为。(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→______→______→C→______。(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置,则C装置的作用是______,通过______现象即可证明亚硫酸酸性强于碳酸。(4)丙同学将A中产生的足量的SO2通入上图装置G中,G中有白色沉淀生成。该沉淀的化学式为______。推测产生沉淀的原因可能是(不考空气的影响)原因一:SO2在酸性条件下被NO3-氧化;原因二:SO2被Fe3+氧化;原因三:。若是原因二,需证明Fe3+的还原产物,其实验操作及现象是。(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0gNa2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20mol•L-1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。达到滴定终点时锥形瓶中溶液颜色变化是______,样品中Na2SO3质量分数是。27.软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如图(中间产物的固体部分已经略去)。已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。Ⅱ.各种金属离子完全沉淀的pH如表:Zn2+Mn2+Fe2+Fe3+Al3+pH8.010.19.03.24.7回答下列问题:(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是______(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______。(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是______。(3)步骤③中MnO2的其作用是______,另外一种物质X可以是______。A.ZnOB.MgC...