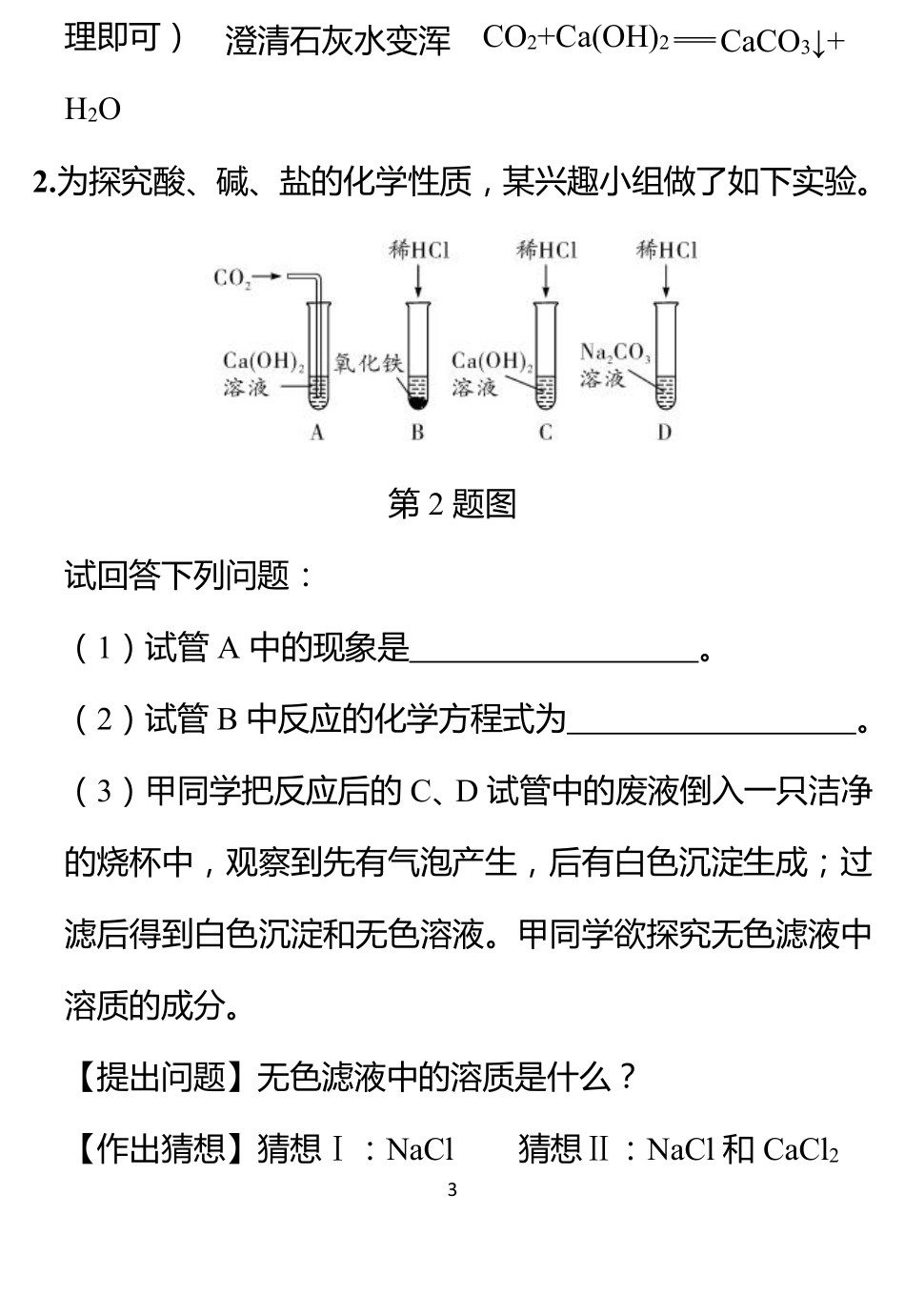
1科学探究1.兴趣小组的同学在课外阅读时发现:金属钠的氧化物——过氧化钠(Na2O2)是一种化学性质活泼的淡黄色固体,在常温下能跟许多物质发生化学反应放出氧气。例如:2Na2O2+2CO22Na2CO3+O2,2Na2O2+2H2O4NaOH+O2↑等,于是同学们将一小块过氧化钠投入一定质量的MgCl2溶液中,充分反应后过滤,得到无色滤液和白色固体,并对滤液的成分进行了探究。【提出问题】滤液中溶质的成分是什么?【猜想与假设】猜想一:NaCl猜想二:猜想三:NaCl、MgCl2猜想四:NaCl、MgCl2、NaOH小芳同学提出猜想四不合理,理由是。2【实验方案与验证】实验实验操作实验现象实验结论实验一取少量滤液于试管中,向其中滴加无色酚酞溶液无明显现象猜想不成立实验二另取少量滤液于试管中,向其中滴加氢氧化钠溶液产生白色沉淀猜想成立【拓展与延伸】由题干可知过氧化钠能与二氧化碳反应,若保存不善会发生变质,检验某过氧化钠固体是否变质,可以取样滴加;将产生的气体通入澄清石灰水中,若观察到,产生此现象的原因是(用化学方程式表示),说明该过氧化钠固体已变质。【答案】【猜想与假设】NaCl、NaOH氢氧化钠与氯化镁在溶液中会反应生成氢氧化镁沉淀,不能共存【实验方案与验证】二三【拓展与延伸】足量稀盐酸(合3理即可)澄清石灰水变浑CO2+Ca(OH)2CaCO3↓+H2O2.为探究酸、碱、盐的化学性质,某兴趣小组做了如下实验。第2题图试回答下列问题:(1)试管A中的现象是。(2)试管B中反应的化学方程式为。(3)甲同学把反应后的C、D试管中的废液倒入一只洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成;过滤后得到白色沉淀和无色溶液。甲同学欲探究无色滤液中溶质的成分。【提出问题】无色滤液中的溶质是什么?【作出猜想】猜想Ⅰ:NaCl猜想Ⅱ:NaCl和CaCl24猜想Ⅲ:NaCl和Na2CO3猜想Ⅳ:NaCl、CaCl2和Na2CO3小明认为猜想Ⅳ一定不成立,其原因是(用化学方程式表示)。【进行实验】实验步骤实验现象实验结论Ⅰ.取少量滤液于试管中,滴加少量碳酸钠溶液无明显现象猜想②成立Ⅱ.取少量滤液于试管中,滴加少量①有气泡产生【答案】(1)溶液变浑浊(2)Fe2O3+6HCl2FeCl3+3H2O(3)【作出猜想】CaCl2+Na2CO3CaCO3↓+2NaCl【进行实验】①稀盐酸(或稀硫酸)②Ⅲ3.氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙与水反应生成氢氧化钙5和氢气。探究小组的同学把一定量的CaH2加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。【提出问题】滤液中溶质的成分是什么?【猜想与假设】猜想一:NaOH猜想二:NaOH、Ca(OH)2猜想三:NaOH、Na2CO3猜想四:NaOH、Na2CO3、Ca(OH)2经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因。【实验验证】实验现象结论(1)取少量滤液,向其中滴入少量碳酸钠溶液无明显现象猜想不成立(2)另取少量滤液,向其中加入足量稀盐酸猜想三成立6【反思与拓展】(1)写出氢化钙(CaH2)与水反应的化学方程式。(2)若向NH4Cl的溶液中加一定量CaH2,充分反应,产生的气体有氢气和。(3)登山运动员携带CaH2作为能源提供剂与携带氢气相比,其优点是(写一条即可)。【答案】【猜想与假设】Ca(OH)2+Na2CO3CaCO3↓+2NaOH【实验验证】(1)二(2)有气泡产生【反思与拓展】(1)CaH2+2H2OCa(OH)2+2H2↑(2)氨气(3)携带安全(或携带方便等,合理即可)【答案】【猜想与假设】由于碳酸钠能与氢氧化钙反应,所以二者在溶液中不能共存,反应的化学方程式为Ca(OH)2+Na2CO3CaCO3↓+2NaOH。【实验验证】(1)碳酸钠能与氢氧化钙反应生成碳酸钙白色沉淀,滴加碳酸钠溶液无7明显现象,说明溶液中没有氢氧化钙,猜想二不成立。(2)碳酸钠能与稀盐酸反应产生气体,根据实验结论“猜想三成立”,可知溶液中有碳酸钠,所以滴加足量的稀盐酸,实验现象为有气泡产生。【反思与拓展】(1)氢化钙与水发应生成氢氧化钙和氢气,反应的化学方程式为CaH2+2H2OCa(OH)2+2H2↑。(2)氢化钙和水反应生成氢氧化钙和氢气,氯化铵能与碱反应产生氨气,所以向氯化铵溶液中加入一定量CaH2,产生的气体除氢气外,还有氨气。(3)氢化钙是...