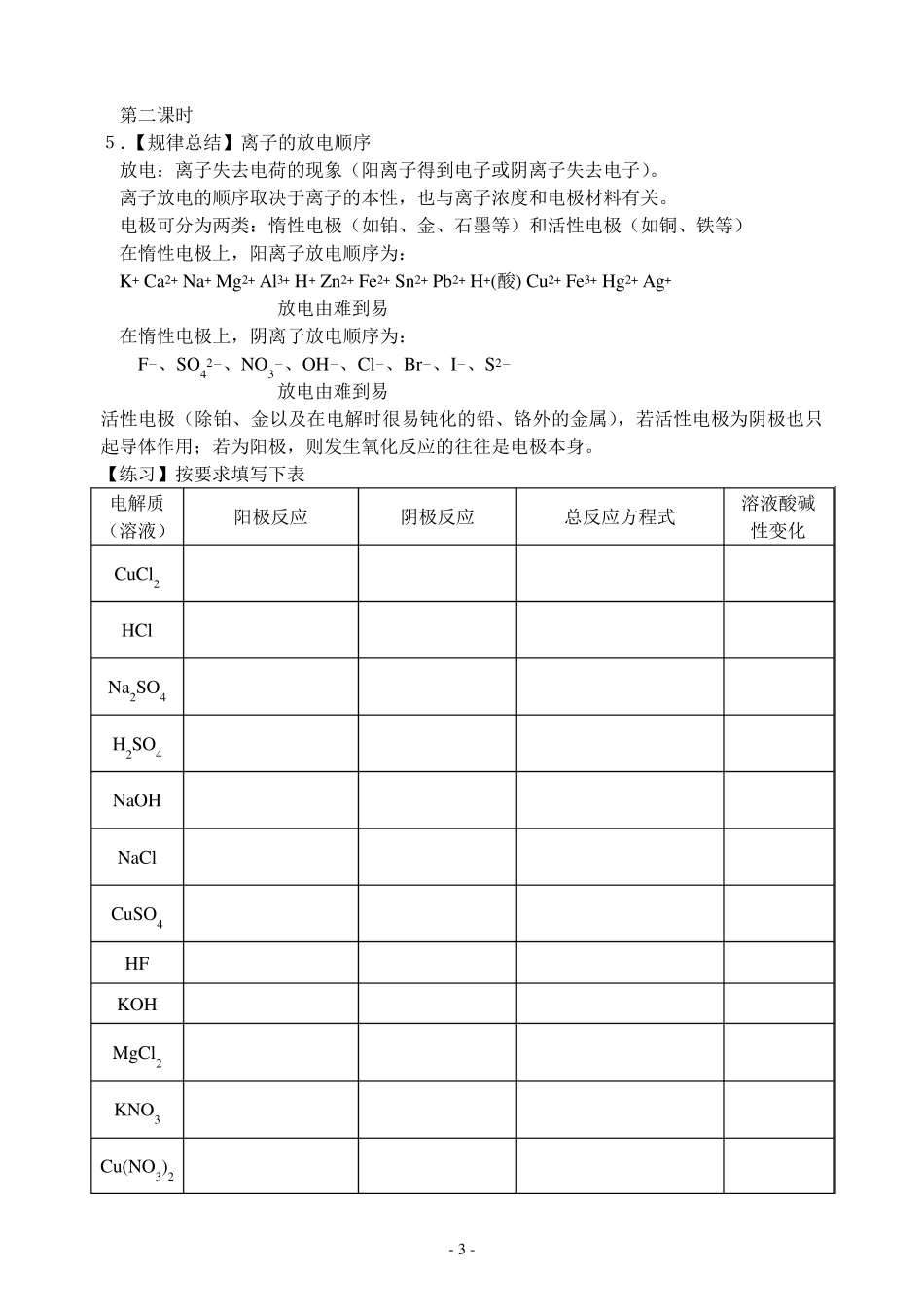
- 1 - 电解原理学案 【学习目标】 1.掌握电解原理。 2.记住离子的放电顺序。 【学习重点】原理 【学习内容】 第一课时 一.电解原理 【演示实验】 电解Cu Cl2 现象 _________________________________ _________________________________ 1 .电解的原理和装置 电解概念__________________ 电解池____________________ 2 .电解池中两极 阴极_____________________ 阳极______________________ 3.电解原理 4.电解池形成条件①___________________ ②___________________ ③___________________ - 2 - [对比]原电池和电解池的比较 装置 原电池 电解池 实例 原理 形成条件 电极名称 电子流向 电流方向 电极反应 能量转变 应用 【例题】在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是 A.原电池的正极和电解池的阳极所发生的反应 B.原电池的正极和电解池的阴极所发生的反应 C.原电池的负极和电解池的阳极所发生的反应 D.原电池的负极和电解池的阴极所发生的反应 【练习题】能用电解原理说明的问题是( ) ① 电解是把电能转变成化学能 ② 电解是把化学能转变成电能 ③ 电解质溶液导电是化学变化,金属导电是物理变化 ④ 不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤ 任何溶液被电解时,必将导致氧化还原反应的发生 A.①②③④ B.②③⑤ C.③④ D.①③④⑤ - 3 - 第二课时 5.【规律总结】离子的放电顺序 放电:离子失去电荷的现象(阳离子得到电子或阴离子失去电子)。 离子放电的顺序取决于离子的本性,也与离子浓度和电极材料有关。 电极可分为两类:惰性电极(如铂、金、石墨等)和活性电极(如铜、铁等) 在惰性电极上,阳离子放电顺序为: K+ Ca2+ Na+ Mg2+ Al3+ H+ Zn2+ Fe2+ Sn2+ Pb2+ H+(酸) Cu 2+ Fe3+ Hg2+ Ag+ 放电由难到易 在惰性电极上,阴离子放电顺序为: F-、SO42-、NO3-、OH-、Cl-、Br-、I-、S2- 放电由难到易 活性电极(除铂、金以及在电解时很易钝化的铅、铬外的金属),若活性电极为阴极也只起导体作用;若为阳极,则发生氧化反应的往往是电极本身...