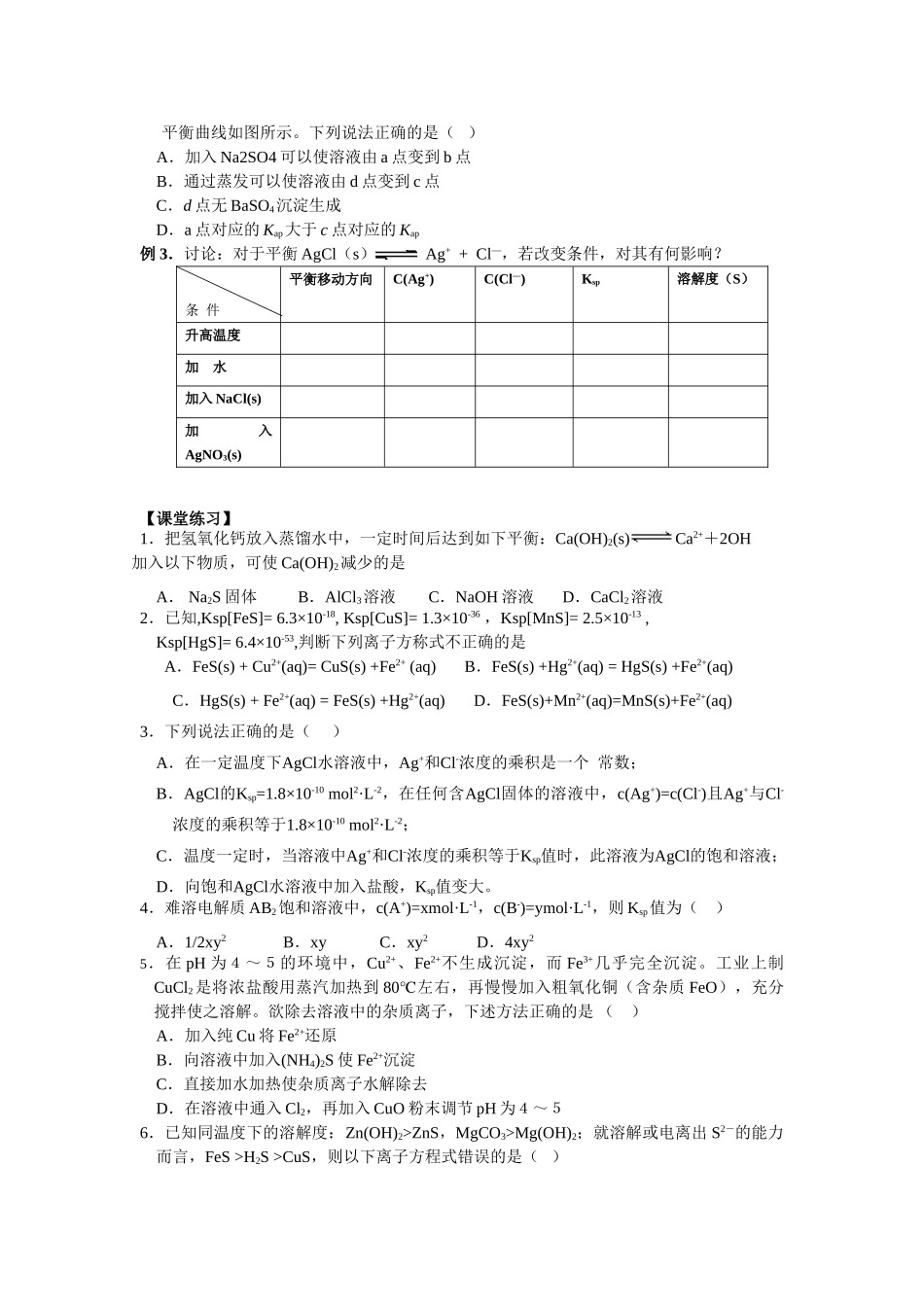
难溶电解质的沉淀溶解平衡【考试要求】了解难溶电解质的溶解平衡。知道沉淀转化的本质。了解沉淀溶解平衡的应用【命题趋势】难溶电解质的溶解平衡是新课程的内容。沉淀的溶解和转化与弱电解质的电离平衡及元素化合物等重要知识密切关联。Ksp与离子浓度的关系及其对应计算已成为高考的新的热点。命题的形式常常结合图像来考察学生的读题能力。【要点梳理】一、沉淀溶解平衡: 沉淀溶解过程—速率 v1 AgCl(s) Ag+ + Cl— 沉淀生成过程—速率 v2v1 > v2 ,溶液 ;v1 = v2 溶解的沉淀 = 生成的沉淀,溶液饱和——处于 状态;v1 ﹤ v2 ,溶液过饱和。1、概念: ,人们将这种平衡称为沉淀溶解平衡。2、特点:逆:是一个可逆的过程 等:v1 = v2 动:v1 = v2 ≠ 0——动态平衡定:溶液中溶质的分子或离子的浓度不再变化。变:当条件改变时,溶质的溶解平衡可发生移动,达到新的平衡。3、影响沉淀溶解平衡的因素:(1)内因:溶质本身的性质①绝对不溶的物质是没有的。② 同是难溶物质,溶解度差别也很大。③ 易溶溶质只要是饱和溶液也可存在溶解平衡。(2)外因:遵循平衡移动原理① 浓度:加水,平衡向 方向移动。② 温度:升温,多数平衡向 方向移动。 少数平衡向生成沉淀的方向移动,如 Ca(OH)2的溶解平衡。二、溶度积常数:(简称溶度积) 表示: Ksp 特点:一定温度下,为一常数。 Ksp的大小反映了难溶物在水中的溶解能力。Ksp越大,其溶解能力越强。对于平衡 AgCl(s) Ag+ + Cl—,运用 Ksp与溶液中的离子积 Qc 的关系分析:增加C(Ag+)或 C(Cl—),平衡为什么向生成沉淀的方向移动? Qc = C(Ag+) C(Cl﹒—)Qc > Ksp 时: 平衡向 的方向移动——有 生成 Qc = Ksp 时: 平衡不移动Qc ﹤ Ksp 时: 平衡向 的方向移动——沉淀溶解三、沉淀溶解平衡的应用:沉淀溶解平衡作为一种动态的平衡,我们可以通过改变条件,控制其进行的方向,沉淀转为溶液中的离子,或者溶液中的离子转化为沉淀。1.沉淀的溶解与生成利用溶度积 KSP可以判断沉淀的生成、溶解情况以及沉淀溶解平衡移动方向。A.当 Qc > Ksp 时是 溶液,反应向 进行,直至达到沉淀溶解平衡状态(饱和为止)。B.当 Qc = Ksp 时是 溶液,达到沉淀溶解平衡状态。C.当 Qc < Ksp 时是 溶液,反应向 进行,直至达到沉淀溶解平衡状态(饱和为止)。 以上规则称为溶度积规则。沉淀的生成和溶解这两个相反...