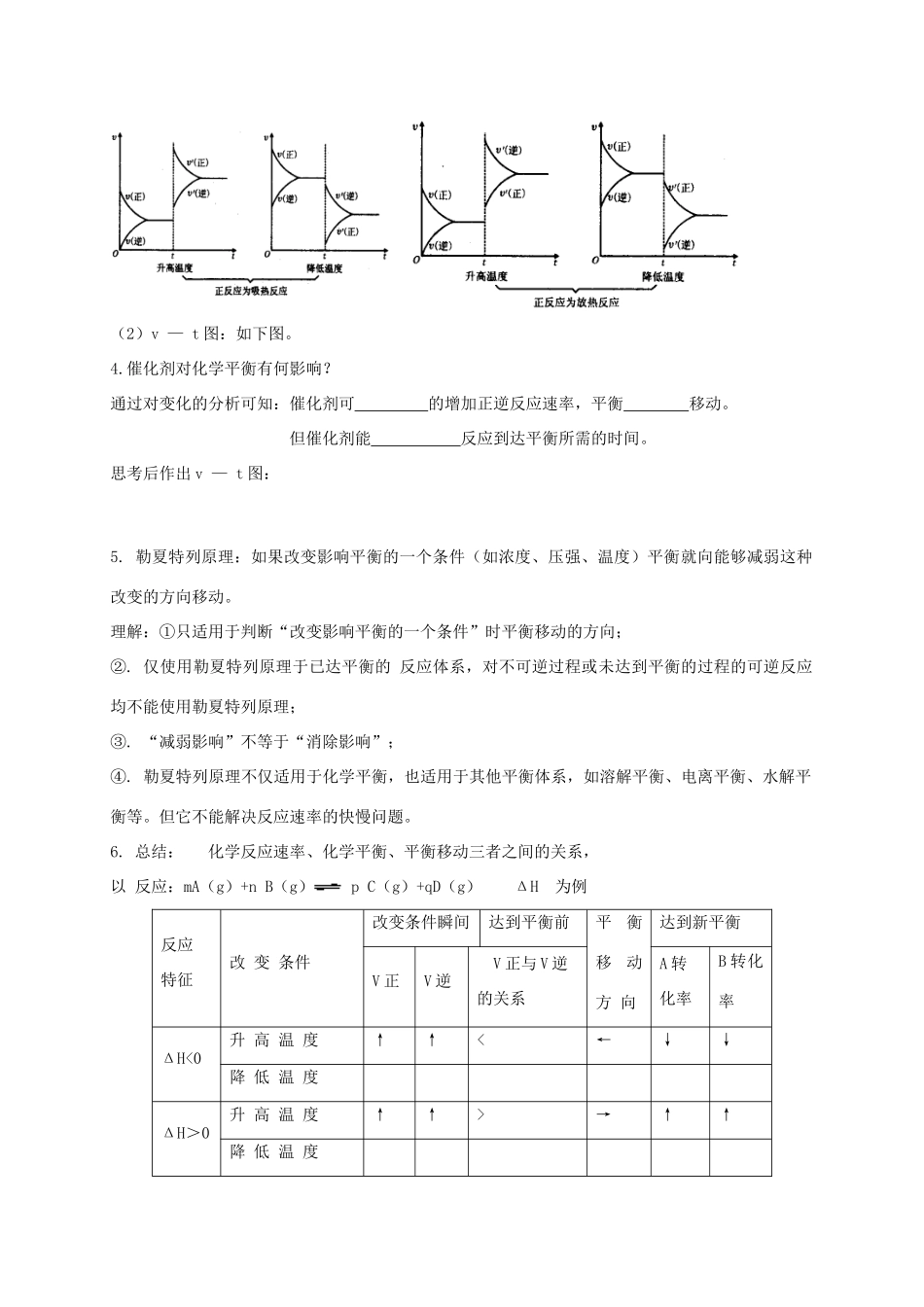
第二章 第三节 化学平衡(学案)第 二 课时【学习目标】: 理解压强、温度对化学平衡的影响,并能利用勒夏特列原理加以解释。【重、难点】: 压强、温度对化学平衡的影响【复 习】 :1.他条件不变的情况下,增大反应物浓度,或减小生成物浓度,化学平衡向 移动。减小反应物浓度,或增大生成物浓度,化学平衡向 移动。2.已知氯水中存在如下平衡: Cl2+H2O HCl+HClO。常温下,在一个体积为 50ml 的针筒内吸入40mL 氯气后,再吸入 10mL 的水。写出针筒中可能观察到的现象。若将此针筒长时间放置,又可以看到何种变化?试用平衡的观点加以解释。【学习过程】2. 压强对化学平衡的影响: 如可逆反应 aA (g) + bB(g) cC (g) (1)推断 :若 a+b ﹥c 即反应前气体体积大于反应后气体体积:① 增大体系的压强,V 正和 V 逆都增大,但 V 正增大的倍数 于 V 逆增大的倍数,则平衡向 反应方向移动。② 减小体系的压强,V 正和 V 逆都减小,但 V 正减小的倍数 于 V 逆减小的倍数,则平衡向 反应方向移动。(2)v — t 图:如右图。注意:与浓度的影响 v — t 图有 何差别?【练习一】 :作出 a+b ﹤c 和a+b = c 时的 v—t 图(3)规律:①.对反应前后气体总体积发生变化的化学反应,在其他条件不变的情况下,增大压强 ,会使化学平衡向着体积____的方向移动;减小压强,会使化学平衡向着体积______的方向移动。②.反应前后气态物质的总体积没有发生变化,增大或减小压强都 使化学平衡移动。③.如果平衡混合物都是固体或液体 ,改变压强 使化学平衡移动。④.加入惰性气体后平衡体系是否发生移动或如何移动,取决于平衡体系中 V 正和 V 逆是否变化或变化的相对大小。【练习二】 :下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?①2NO(g) + O2(g) 2NO2(g)② H2O(g) + CO(g) CO2(g) + H2(g)③ H2O(g) + C(s) CO(g) + H2(g)④ CaCO3(s) CaO(s) + CO2(g)⑤ H2S(g) H2(g) + S(s)【练习三】一定量的混合气体在密闭容器中发生反应: m A (g) + n B (g) p C (g)达到平衡后,温度不变,将气体体积缩小到原来的 1/2,达到新的平衡时,C 的浓度为原来的 1 . 8倍,则下列说法正确的是 ( ) A. m + n > p B. A 的转化率降低C. 平衡向正反应方向移动 D. C 的体积分数增加【练习四】 在一定的温度和压强下,合成...