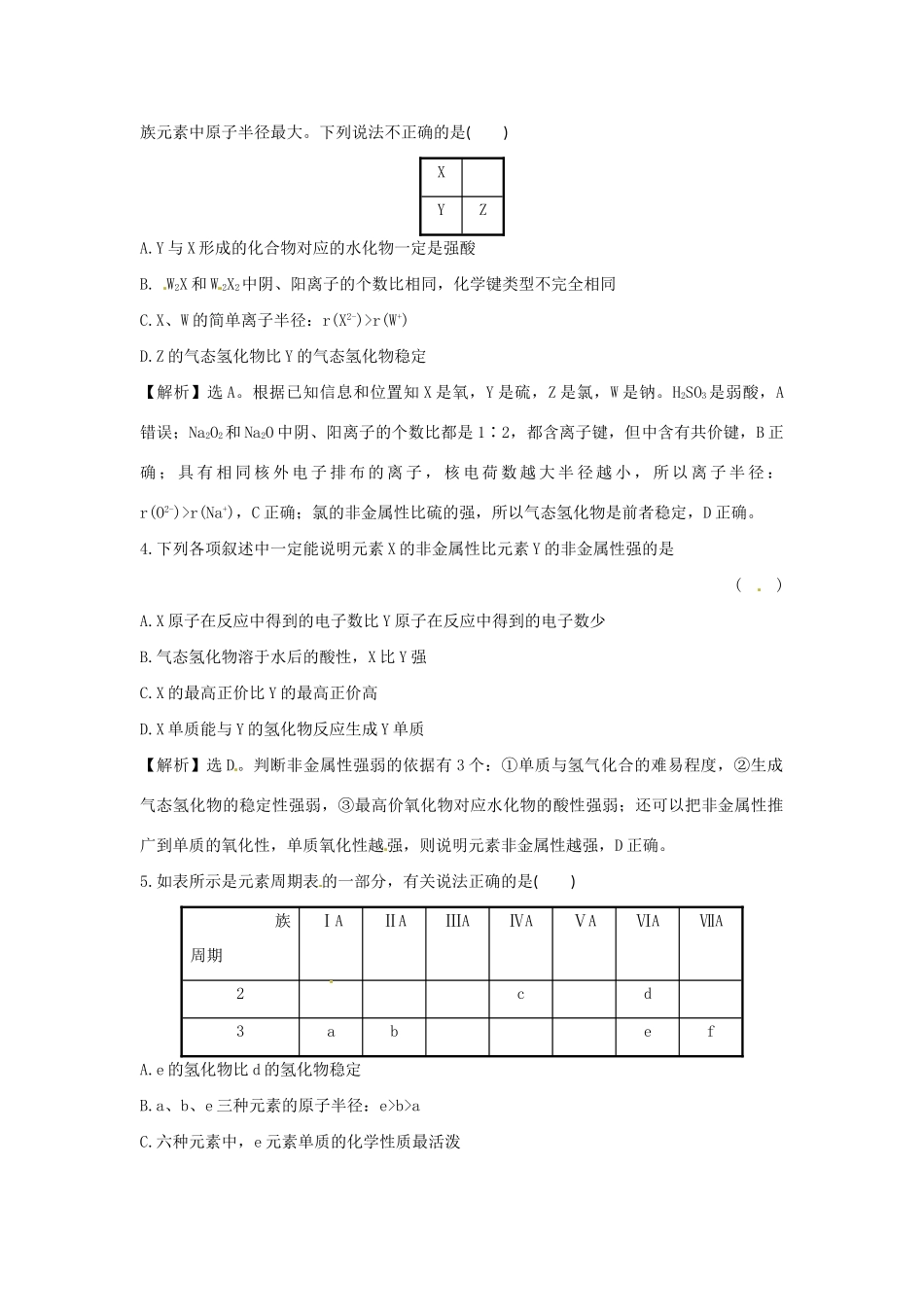
高效演练151.(2015·济南模拟)下列叙述正确的是()A.目前使用的元素周期表中,最长的周期含有36种元素B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素C.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8D.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物【解析】选D。目前使用的元素周期表中,最长的周期含有32种元素,A错误;周期表中并不是所有元素都是从自然界中发现的,B错误;非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8,如五氯化磷等,C错误;ⅠA族与ⅦA族元素间可形成共价化合物如氯化氢,也可形成离子化合物如氯化钠,D正确。2.(2014·上海高考)今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有()A.碱性:KOH>NaOHB.相对原子质量:Ar>KC.酸性:HClO4>H2SO4D.元素的金属性:Mg>Al【解析】选B。同主族从上到下元素的金属性、最高价氧化物的水化物的碱性逐渐增强,同周期从左到右元素的金属性逐渐减弱,A、D正确;元素周期表是按照原子序数从小到大的顺序编排的,不是按照相对原子质量的大小,B错误;同周期从左到右元素的最高价氧化物对应的水化物的酸性逐渐增强,C正确。【加固训练】下列结论错误的是()①微粒半径:K+>Al3+>S2->Cl-②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4③离子的还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se>Te⑤酸性:H2SO4>H3PO4>H2CO3>HClO⑥非金属性:O>N>P>Si⑦金属性:BeCl->K+>Al3+,③中顺序应为S2->I->Br->Cl-。3.X、Y、Z、W是短周期主族元素。已知X是地壳中含量最多的元素,W的原子在短周期主族元素中原子半径最大。下列说法不正确的是()XYZA.Y与X形成的化合物对应的水化物一定是强酸B.W2X和W2X2中阴、阳离子的个数比相同,化学键类型不完全相同C.X、W的简单离子半径:r(X2-)>r(W+)D.Z的气态氢化物比Y的气态氢化物稳定【解析】选A。根据已知信息和位置知X是氧,Y是硫,Z是氯,W是钠。H2SO3是弱酸,A错误;Na2O2和Na2O中阴、阳离子的个数比都是1∶2,都含离子键,但中含有共价键,B正确;具有相同核外电子排布的离子,核电荷数越大半径越小,所以离子半径:r(O2-)>r(Na+),C正确;氯的非金属性比硫的强,所以气态氢化物是前者稳定,D正确。4.下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是()A.X原子在反应中得到的电子数比Y原子在反应中得到的电子数少B.气态氢化物溶于水后的酸性,X比Y强C.X的最高正价比Y的最高正价高D.X单质能与Y的氢化物反应生成Y单质【解析】选D。判断非金属性强弱的依据有3个:①单质与氢气化合的难易程度,②生成气态氢化物的稳定性强弱,③最高价氧化物对应水化物的酸性强弱;还可以把非金属性推广到单质的氧化性,单质氧化性越强,则说明元素非金属性越强,D正确。5.如表所示是元素周期表的一部分,有关说法正确的是()族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA2cd3abefA.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,e元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强【解析】选D。同主族元素从上到下元素氢化物的稳定性减弱,A错误;同周期元素的原子半径从左到右逐渐减小,B错误;a~f六种元素分别为Na、Mg、C、O、S、Cl,其中金属单质Na的化学性质最活泼,非金属单质中Cl2、O2化学性质均比S活泼,C错误。6.(2015·新余模拟)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:(1)画出⑧原子结构示意图______________。(2)④、⑤、⑥的简单离子半径由大到小的顺序是__________(用离子符号表示)。(3)①~⑧的元素中,某元素气态氢化物与其最高价氧化物对应的水化物反应所得生成物溶于水,溶液呈酸性,原因是__________________________________________(用离子方程式表示),该氢化物分子空间结构为________。(4)写出由元素⑥组成的单质与元素⑤最高价氧化物对应的水化物的水溶液反应的离子方程式________________________________。【解析】根据元素在周期表中的位置可知①~⑧分别是H、C、...