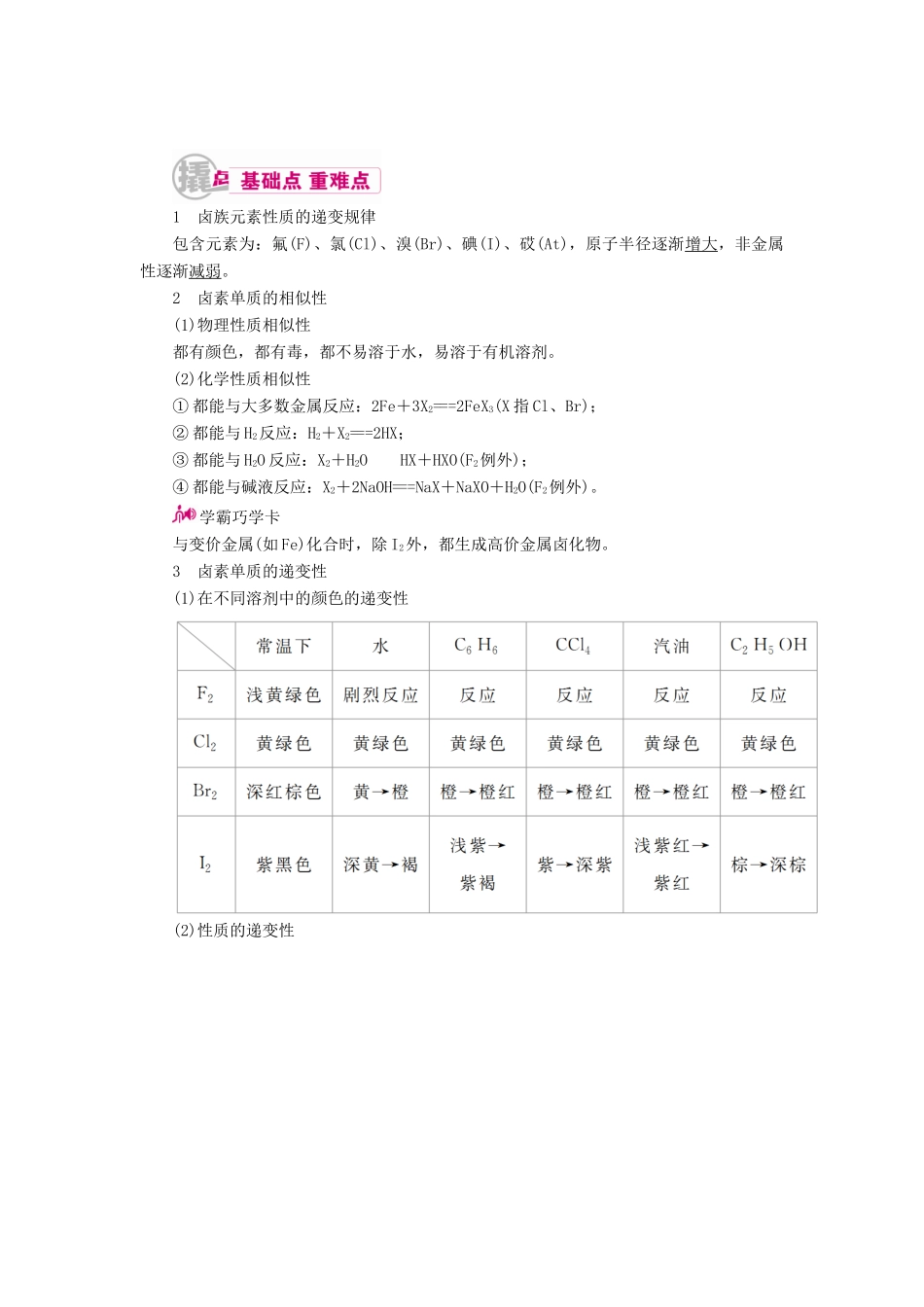
1 卤族元素性质的递变规律包含元素为:氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),原子半径逐渐增大,非金属性逐渐减弱。2 卤素单质的相似性(1)物理性质相似性都有颜色,都有毒,都不易溶于水,易溶于有机溶剂。(2)化学性质相似性① 都能与大多数金属反应:2Fe+3X2===2FeX3(X 指 Cl、Br);② 都能与 H2反应:H2+X2===2HX;③ 都能与 H2O 反应:X2+H2OHX+HXO(F2例外);④ 都能与碱液反应:X2+2NaOH===NaX+NaXO+H2O(F2例外)。学霸巧学卡与变价金属(如 Fe)化合时,除 I2外,都生成高价金属卤化物。3 卤素单质的递变性(1)在不同溶剂中的颜色的递变性(2)性质的递变性4 卤素单质和化合物的特殊性(1)氟①F 无正价,非金属性最强,F-的还原性最弱。②F2与 H2在暗处即发生爆炸。③F2是氧化性最强的非金属单质,与水反应生成 O2:2F2+2H2O===4HF+O2。④HF 是弱酸,能腐蚀玻璃,保存在铅制器皿或塑料瓶中;有毒,在 HX 中沸点最高。(2)溴Br2是常温下唯一呈液态的非金属单质,易挥发且有毒,通常用蜡密封保存在磨口玻璃瓶中,还可加少许水作保护剂抑制 Br2挥发。(3)碘①I2遇淀粉变蓝色,该特性常用于检验 I2。②I2受热时易升华,该特性常用于分离 I2。③I2易与 Na2S2O3溶液反应:I2+2S2O===2I-+S4O,常用于通过滴定(以淀粉为指示剂)来定量测定碘的含量。(4)卤化银① 溶解性:AgCl、AgBr、AgI 均不溶于水和稀硝酸,而 AgF 可溶于水。② 颜色:AgF 白色,AgCl 白色,AgBr 淡黄色,AgI 黄色。③ 感光性:除 AgF 外,均有感光性,其中 AgBr 常作感光材料。④AgI 可用于人工降雨。学霸巧学卡(1)氯水具有漂白性,但 Br2、I2与水反应很微弱,溴水、碘水中 HBrO 和 HIO 很少,漂白性很差。(2)利用浓硫酸和氯化钠反应可以制取 HCl,利用浓硫酸可以干燥 HCl。但不能利用浓硫酸制取和干燥 HBr 和 HI,浓硫酸可把 HBr 和 HI 氧化生成 Br2和 I2。1.思维辨析(1)CCl4可用于鉴别溴水和碘水。( )(2)Cl2+2Br-===2Cl-+Br2为单质被还原的置换反应。( )(3)用 AgNO3溶液可以鉴别 KCl 和 KI。( )(4)验证 Br2的氧化性强于 I2的方法是将少量溴水加入 KI 溶液中,再加入 CCl4振荡、静置,可观察到下层液体呈紫色。( )(5)进行用溴水和 CCl4除去 NaBr 溶液中少量 NaI 时用的实验器材(省略夹持装置)有烧杯、玻璃棒、胶头滴管、分液漏斗。( )(6)向无色溶液中滴加氯水和 CCl4,振荡、静置,下...