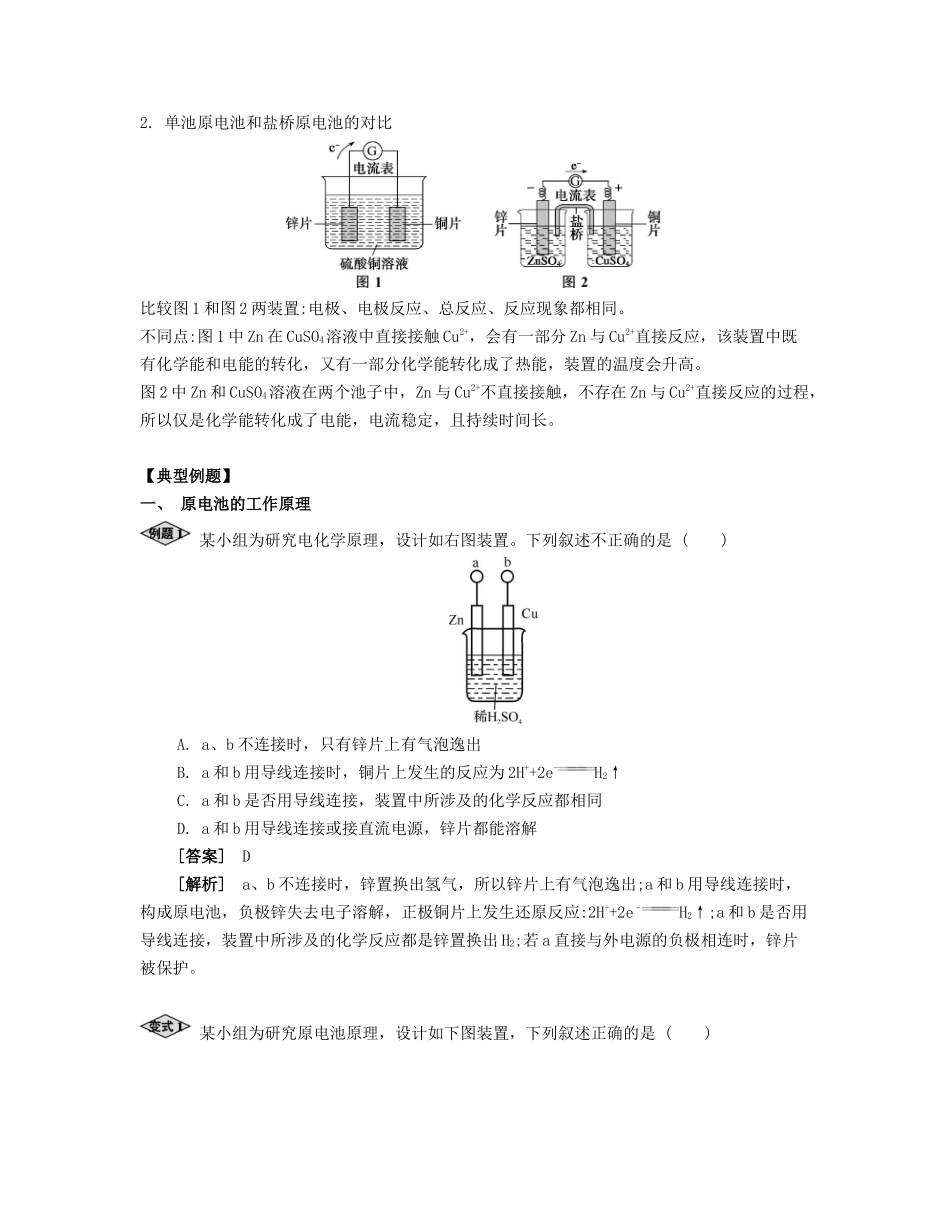
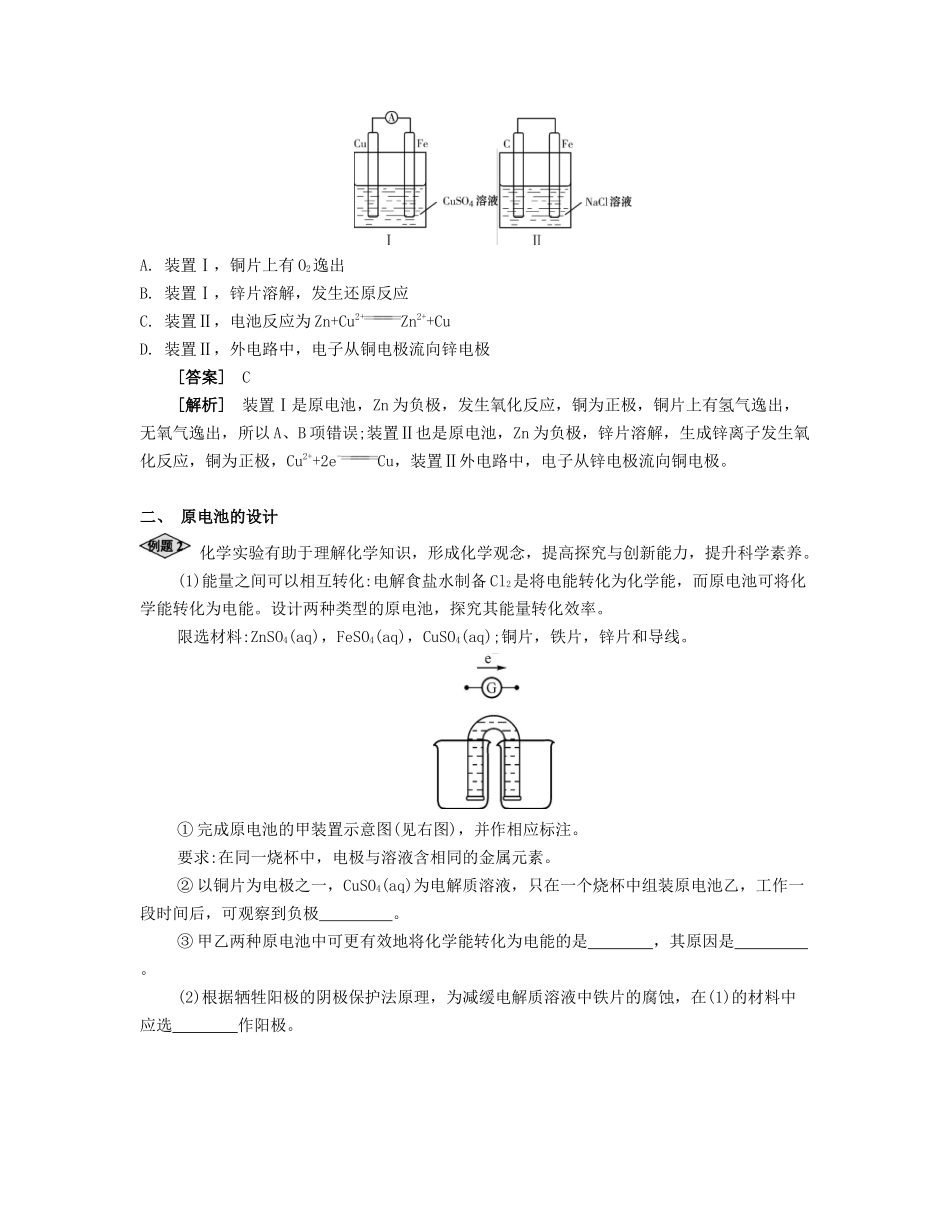
课时22原电池及其应用夯实基础考点过关原电池的工作原理【基础梳理】原电池原理电极反应负极(锌片):Zn-2e-Zn2+正极(铜片):2H++2e-H2↑总反应式:Zn+2H+Zn2++H2↑离子迁移方向阳离子向极移动,阴离子向极移动电子流向与电流流向电子由极流出经导线流向极电流由极流出经导线流向极导线中是电子导电,溶液中是离子导电微课1盐桥的作用1.盐桥及其作用(1)盐桥:盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。(2)盐桥的作用:①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流;③使能量利用转化更高效。:()()()原电池是把转化为的装置能自发进行的氧化还原反应①两个活泼性不同的电极可为活泼性不同的两种金属或一种金属和一种非金属导体形成条件②电极材料插在溶液中③两极相连,形成电子流出的极为极电子流入的极为极电极反应电极反应式与电池总反应式以铜锌原电池为例说明,见下表2.单池原电池和盐桥原电池的对比比较图1和图2两装置:电极、电极反应、总反应、反应现象都相同。不同点:图1中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。图2中Zn和CuSO4溶液在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。【典型例题】一、原电池的工作原理某小组为研究电化学原理,设计如右图装置。下列叙述不正确的是()A.a、b不连接时,只有锌片上有气泡逸出B.a和b用导线连接时,铜片上发生的反应为2H++2e-H2↑C.a和b是否用导线连接,装置中所涉及的化学反应都相同D.a和b用导线连接或接直流电源,锌片都能溶解[答案]D[解析]a、b不连接时,锌置换出氢气,所以锌片上有气泡逸出;a和b用导线连接时,构成原电池,负极锌失去电子溶解,正极铜片上发生还原反应:2H++2e–H2↑;a和b是否用导线连接,装置中所涉及的化学反应都是锌置换出H2;若a直接与外电源的负极相连时,锌片被保护。某小组为研究原电池原理,设计如下图装置,下列叙述正确的是()A.装置Ⅰ,铜片上有O2逸出B.装置Ⅰ,锌片溶解,发生还原反应C.装置Ⅱ,电池反应为Zn+Cu2+Zn2++CuD.装置Ⅱ,外电路中,电子从铜电极流向锌电极[答案]C[解析]装置Ⅰ是原电池,Zn为负极,发生氧化反应,铜为正极,铜片上有氢气逸出,无氧气逸出,所以A、B项错误;装置Ⅱ也是原电池,Zn为负极,锌片溶解,生成锌离子发生氧化反应,铜为正极,Cu2++2e-Cu,装置Ⅱ外电路中,电子从锌电极流向铜电极。二、原电池的设计化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。(1)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。①完成原电池的甲装置示意图(见右图),并作相应标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极。③甲乙两种原电池中可更有效地将化学能转化为电能的是,其原因是。(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(1)的材料中应选作阳极。[答案](1)①②电极逐渐溶解③甲甲可以避免Zn与Cu2+的接触,提高电池效率,提供稳定电流。而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能(2)Zn[解析]①带盐桥的原电池甲可以设计锌铜原电池(或铁铜原电池、锌铁原电池),由于外电路中电子从左移向右,说明左边烧杯中电极的金属性较强,则左、右两边烧杯中电极材料及电解质溶液可以为锌片和硫酸锌溶液、铜片和硫酸铜溶液(或者铁片和硫酸亚铁溶液、铜片和硫酸铜溶液,锌片和硫酸锌溶液、铁片和硫酸亚铁溶液);②金属活动性:Zn>Fe>Cu,则原电池乙中铜片作正极,锌片或铁片作负极,工作一段时间后,负极金属逐渐溶解;③甲、乙两种原电池都能将化学能转化...