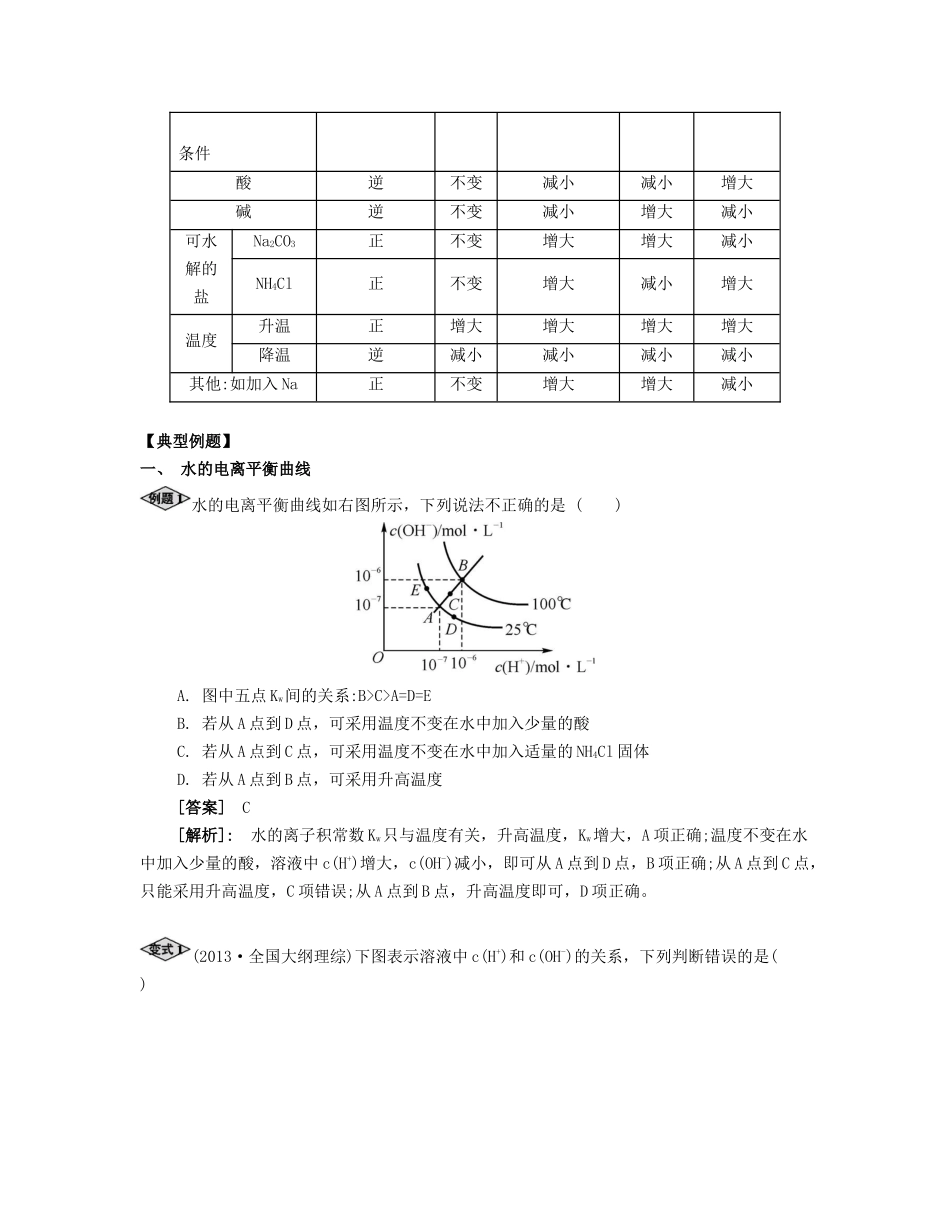
课时30水的电离和溶液的pH夯实基础考点过关水的电离【基础梳理】1.水的电离水是一种电解质,能发生微弱的电离,其电离方程式为。2.水的离子积常数Kw(1)表达式:Kw==(25℃)(2)影响因素:Kw仅仅是温度的函数。温度不变,Kw;温度升高,Kw。不同温度下水的离子积常数T/℃0102025405090100Kw/10-140.1340.2920.6811.012.925.4738.055.03.影响水的电离平衡的因素(1)温度:因为水的电离是吸热过程,故对纯水升高温度,(填“促进”或“抑制”)水的电离,c(H+)和c(OH-)同时(填“增大”、“减小”或“不变”);但因为由水电离出的c(H+)和c(OH-)始终相等,故溶液呈(填“酸”、“碱”或“中”)性。(2)加入酸或碱:向纯水中加入酸(或碱),由于酸(或碱)电离产生H+(或OH-),使水中c(H+)[或c(OH-)](填“增大”、“减小”或“不变”),水的电离平衡向(填“正反应”或“逆反应”)方向移动,水的电离程度(填“增大”、“减小”或“不变”)。(3)加入弱碱阳离子或弱酸根阴离子:由于弱碱阳离子与水电离出的OH-结合生成弱碱;弱酸根阴离子与水电离出的H+结合生成了弱酸,从而使水中的c(OH-)或c(H+)(填“增大”、“减小”或“不变”),破坏了水的电离平衡,使水的电离平衡向(填“正反应”或“逆反应”)方向移动,其电离程度(填“增大”、“减小”或“不变”)。微课1外界条件对水的电离平衡及Kw的影响(1)水的离子积常数Kw=c(H+)c(OH-),Kw不仅适用于纯水,也适用于酸性或碱性稀的电解质水溶液。Kw其实质是水溶液中的H+和OH-浓度的乘积。在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。(2)外界条件的改变,对水的电离平衡和Kw的影响体系变化平衡移动方向Kw水的电离程度c(OH-)c(H+)条件酸逆不变减小减小增大碱逆不变减小增大减小可水解的盐Na2CO3正不变增大增大减小NH4Cl正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小其他:如加入Na正不变增大增大减小【典型例题】一、水的电离平衡曲线水的电离平衡曲线如右图所示,下列说法不正确的是()A.图中五点Kw间的关系:B>C>A=D=EB.若从A点到D点,可采用温度不变在水中加入少量的酸C.若从A点到C点,可采用温度不变在水中加入适量的NH4Cl固体D.若从A点到B点,可采用升高温度[答案]C[解析]:水的离子积常数Kw只与温度有关,升高温度,Kw增大,A项正确;温度不变在水中加入少量的酸,溶液中c(H+)增大,c(OH-)减小,即可从A点到D点,B项正确;从A点到C点,只能采用升高温度,C项错误;从A点到B点,升高温度即可,D项正确。(2013·全国大纲理综)下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是()A.两条曲线间任意点均有c(H+)·c(OH-)=KwB.M区域内任意点均有c(H+)0,下列叙述正确的是()A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变C.升高温度,Kw变大,pH降低,水显酸性D.向水中加入少量氢氧化钠,c(OH-)增大,25℃时Kw增大[答案]B[解析]:A项,加入稀氨水后水溶液中的c(OH-)增大,平衡逆向移动;B项,NaHSO4溶于水,电离使c(H+)增大,由于温度不变,故Kw不变;C项,升高温度,促进水的电离,但是c(H+)=c(OH-),水依然显中性;D项,向水中加入少量氢氧化钠,c(OH-)增大,Kw保持不变。一定温度下,水存在H2OH++OH-ΔH=Q(Q>0)的平衡,下列叙述一定正确的是()A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小B.将水加热,Kw增大,pH减小C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低D.向水中加入少量固体硫酸钠,c(H+)=10-7mol·L-1,Kw不变[答案]B[解析]:A项,Kw应不变;C项,平衡应正向移动;D项,由于没有指明温度,c(H+)...