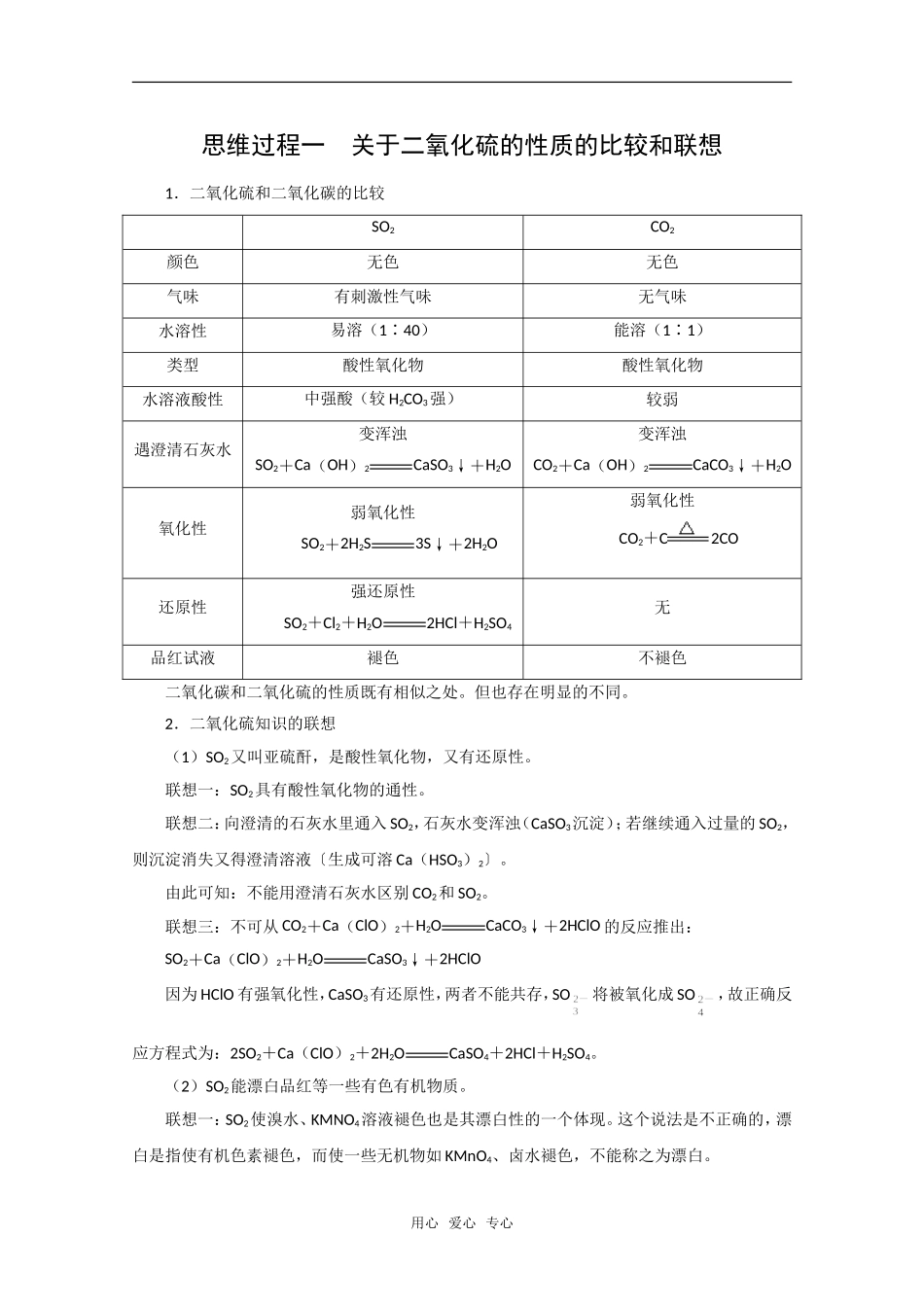
思维过程一关于二氧化硫的性质的比较和联想1.二氧化硫和二氧化碳的比较SO2CO2颜色无色无色气味有刺激性气味无气味水溶性易溶(1∶40)能溶(1∶1)类型酸性氧化物酸性氧化物水溶液酸性中强酸(较H2CO3强)较弱遇澄清石灰水变浑浊SO2+Ca(OH)2CaSO3↓+H2O变浑浊CO2+Ca(OH)2CaCO3↓+H2O氧化性弱氧化性SO2+2H2S3S↓+2H2O弱氧化性CO2+C2CO还原性强还原性SO2+Cl2+H2O2HCl+H2SO4无品红试液褪色不褪色二氧化碳和二氧化硫的性质既有相似之处。但也存在明显的不同。2.二氧化硫知识的联想(1)SO2又叫亚硫酐,是酸性氧化物,又有还原性。联想一:SO2具有酸性氧化物的通性。联想二:向澄清的石灰水里通入SO2,石灰水变浑浊(CaSO3沉淀);若继续通入过量的SO2,则沉淀消失又得澄清溶液〔生成可溶Ca(HSO3)2〕。由此可知:不能用澄清石灰水区别CO2和SO2。联想三:不可从CO2+Ca(ClO)2+H2OCaCO3↓+2HClO的反应推出:SO2+Ca(ClO)2+H2OCaSO3↓+2HClO因为HClO有强氧化性,CaSO3有还原性,两者不能共存,SO将被氧化成SO,故正确反应方程式为:2SO2+Ca(ClO)2+2H2OCaSO4+2HCl+H2SO4。(2)SO2能漂白品红等一些有色有机物质。联想一:SO2使溴水、KMNO4溶液褪色也是其漂白性的一个体现。这个说法是不正确的,漂白是指使有机色素褪色,而使一些无机物如KMnO4、卤水褪色,不能称之为漂白。用心爱心专心联想二:SO2虽然具有漂白性,但漂白范围没有Cl2(HClO)、Na2O2广泛,它不能使酸碱指示剂褪色。常见可被SO2漂白的物质有:品红溶液、纸浆、毛、丝、草编制品和有色花等。(3)SO2的主要用途:漂白剂、防腐剂、制硫酸等。SO2引发的环境污染,主要危害是:SO2有毒,它对人体的直接危害是引发呼吸道疾病;SO2对大气污染的后果是随雨水降落到地面,形成硫酸型酸雨(pH<5.6),能直接破坏农作物、森林和草原,使土壤酸性增强。酸雨还会使湖泊酸化,造成鱼类等死亡。另外,酸雨还会加速桥梁等建筑物、石雕等文物、工业设备、农田水利设施,以及电信电缆等的腐蚀。防治SO2污染的方法有:①开发新能源(氢能、核能、太阳能等)取代化石燃料;②对含硫燃料预先进行脱硫处理,以降低SO2的排放;③大量种植柳杉、垂柳等可吸收SO2的植物;④用化学方法对含SO2的尾气进行处理或回收。例如:a.生石灰固硫法:SO2+CaOCaSO32CaSO3+O22CaSO4b.亚硫酸钠溶液吸收法:SO2+Na2SO3+H2O2NaHSO3c.石灰水悬浊液洗涤法:SO2+Ca(OH)2CaSO3↓+H2O2CaSO3+O22CaSO4d.氨水脱硫法:SO2+2NH3+H2O(NH4)2SO3SO2+NH3+H2ONH4HSO32(NH4)2SO3+O22(NH4)2SO4思维过程二硫酸的性质和硫酸根离子的检验1.硫酸的性质要分浓硫酸和稀硫酸分别讨论,因为浓度不同它们在性质上有着明显的差异。浓硫酸和稀硫酸的组成与性质的比较浓硫酸稀疏酸电离情况H2SO42H++SO主要粒子H2SO4分子H+、SO、(H2O)颜色、状态无色黏稠油状液体无色液体用心爱心专心化学性质三大特性:脱水性吸水性强氧化性酸的五项通性:1.与酸、碱指示剂反应2.与活泼金属反应生成盐和氢气3.与碱性氧化物反应生成盐和水4.与某些盐反应生成新酸和新盐5.与碱反应生成盐和水浓硫酸物理上的特性,是它的高沸点、难挥发性,98.3%的浓硫酸沸点为338℃,利用这个性质通常用来制取易挥发的酸,如用浓硫酸和食盐晶体加热制氯化氢气体。浓硫酸化学上的特性:吸水性、脱水性、强氧化性。(1)吸水性和脱水性的异同:吸水指吸收物质中原本存在的H2O分子(包括游离的和结晶水合物的水分子);脱水指将许多有机物中H、O两种元素按水分子中原子个数比2∶1的比例(即H2O)脱去,从而使有机物炭化。这两个过程部属于化学变化,并且放出能量。(2)浓硫酸氧化性和稀硫酸氧化性的比较:浓硫酸稀硫酸起氧化作用的元素分子中的+6价S电离出来的H+还原产物一般是SO2H2与Cu反应加热时能氧化Cu不反应与Fe、Al反应常温下将Fe、Al钝化加热时能继续氧化均发生置换反应与非金属单质、H2S、HBr、HI等物质反应加热时能氧化非金属单质,常温时能氧化H2S、HBr、HI均不反应氧化性的强弱情况氧化性强氧化性弱在这里我们要分清楚氧化性的酸和酸的氧化性是两个...