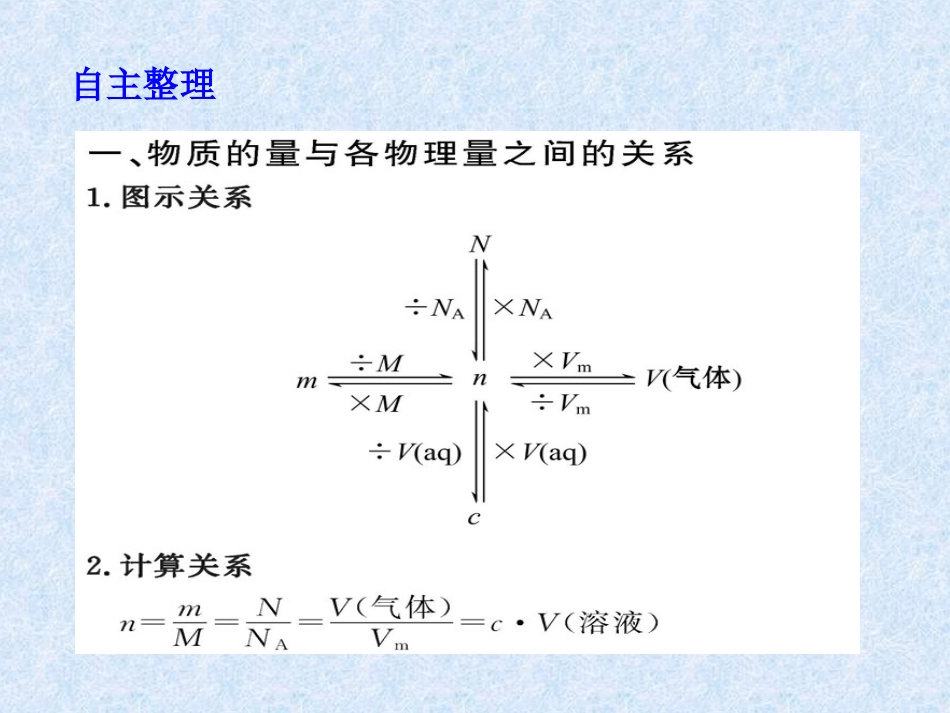
第三章金属及其化合物第一节金属的化学性质教学目标自主整理点拨思考提示特别提醒【例1】把1.1g铁、铝混合物溶于200mL5mol·L-1盐酸中,反应后盐酸的浓度变为4.6mol·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量。(2)该混合物中铝、铁的物质的量。【点拨】解答本题要注意以下三点:【自主解答】(1)消耗HCl的物质的量:0.2L×5mol·L-1-0.2L×4.6mol·L-1=0.08mol(2)设Al、Fe的物质的量分别为x、y。2Al+6HCl====2AlCl3+3H2↑2mol6molx3xFe+2HCl====FeCl2+H2↑1mol2moly2y27g·mol-1×x+56g·mol-1×y=1.1g3x+2y=0.08mol得x=0.02mol,y=0.01mol。答案:(1)0.08mol(2)Al:0.02mol;Fe:0.01mol特别提醒【例2】Na2CO3、NaHCO3的混合物与100mL3mol/L盐酸恰好反应,产生4.48L(标准状况)能使澄清石灰水变浑浊的气体,请计算混合物中Na2CO3的物质的量。【点拨】解答本题要注意以下三点:【自主解答】设Na2CO3的物质的量为x,NaHCO3的物质的量为y。反应产生的CO2的物质的量为所以根据碳原子守恒可知,x+y=0.2mol;又因为反应恰好进行,说明反应后溶液中溶质为NaCl,根据钠离子、氯离子守恒可知,2x+y=0.3mol,联立上述两式可得:x=y=0.1mol,即混合物中Na2CO3的物质的量为0.1mol。答案:0.1mol4.48mol0.2mol22.4=,1.在500mLNaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体6.72L,生成物NaAlO2的物质的量浓度为(假定反应前后,溶液体积不变)()A.1mol/LB.0.4mol/LC.1.5mol/LD.2mol/L巩固练习【解析】选B。设NaAlO2物质的量浓度为c,则2Al+2NaOH+2H2O====2NaAlO2+3H2↑2mol3×22.4L0.5L·c6.72L2mol∶(0.5L·c)=3×22.4L∶6.72L解得c=0.4mol/L。2.将4.6g金属钠投入到95.4g水中,得到的溶液溶质的质量分数为()A.等于4.6%B.等于8.0%C.大于8.0%D.小于8.0%【解析】选C。设生成的氢氧化钠、氢气的质量分别为x、y2Na+2H2O====2NaOH+H2↑2×23g2×40g2g4.6gxy则有解得x=8g;解得y=0.2g,所以生成的氢氧化钠的质量分数为223g240g4.6gx=,223g2g4.6gy=,8g100%8.02%8%4.6g95.4g0.2g>。3.向500mLNaOH溶液中投入5.4gAl,二者恰好完全反应,计算:(1)Al的物质的量。(2)NaOH溶液的物质的量浓度。【解析】(1)Al的物质的量为(2)二者的反应为2Al+2NaOH+2H2O====2NaAlO2+3H2↑,所以n(NaOH)=n(Al)=0.2mol,则答案:(1)0.2mol(2)0.4mol/L5.4g0.2mol27g/mol=。0.2molcNaOH0.4mol/L0.5L。