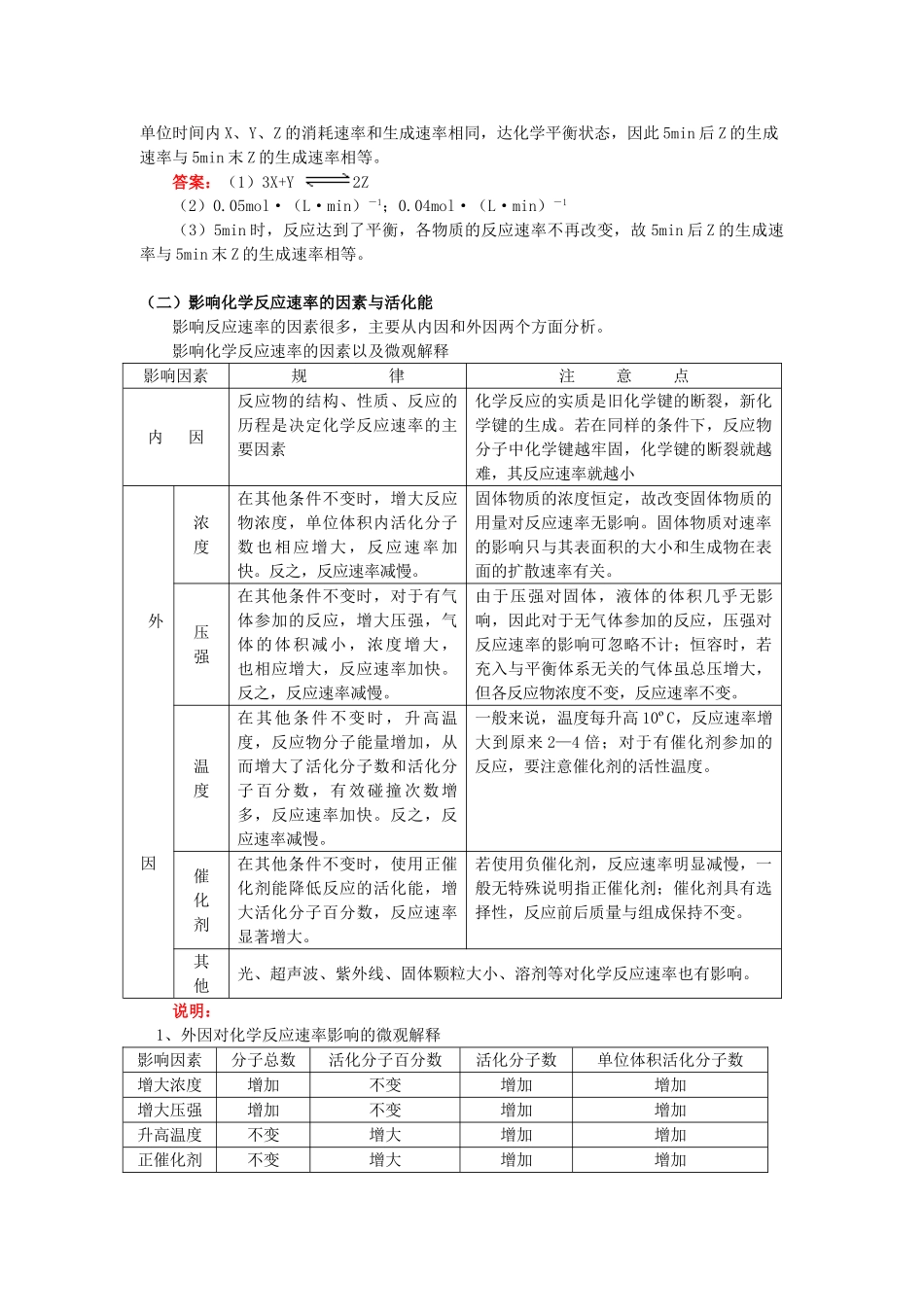
化学反应速率、化学反应进行的方向【本讲教育信息】一.教学内容:化学反应速率、化学反应进行的方向二、教学目标了解化学反应速率的概念、反应速率的定量表示方法;了解活化能对化学反应速率的影响,认识温度、浓度、压强和催化剂影响化学反应速率的一般规律了解化学反应的可逆性。能用焓变和熵变说明常见化学反应的方向三、教学重点、难点化学反应速率的定量表示方法;条件对化学反应速率的影响四、教学过程:(一)化学反应速率的概念及定量表示方法:化学反应速率是指化学反应进行的快慢程度,一般表示方法为:以单位时间内反应物浓度的减少或生产物浓度的增加表示表示方法:以单位时间内反应物浓度的减少或生产物浓度的增加表示。计算式:V=Δc/Δt(mol/L·s或mol/L·min)说明:1、同一反应的反应速率只有一个。同一化学反应,用不同的物质表示的反应速率,可能相同,也可能不同。但各物质的速率之比等于化学方程式中相应物质的化学计量数之比,等于各相应物质的浓度的变化量之比,等于各相应物质的物质的量的变化量之比。2、反应速率为平均速率,非瞬时反应速率。3、固体或纯液体(注意不是溶液)的浓度可视为不变的常数,一般不用固体或纯液体表示化学反应速率。注意纯液体(如无水乙醇)与溶液(如乙醇水溶液)不同。4、比较速率的大小要以单位一致为前提。5、求反应速率的途径一般有两条:一是根据反应速率的定义求;二是根据速率之比=浓度的变化量之比=物质的量的变化量之比=化学计量数之比。[例1]已知反应A+3B===2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为A、0.5mol·L-1·min-1B、1mol·L-1·min-1C、2mol·L-1·min-1D、3mol·L-1·min-1解析:同一化学反应,在同一时间内用不同物质表示的反应速率,其数值可能相同也可能不同,但表达的意思相同,都表示了同一反应在该时间内的反应速率,且反应速率之比等于方程式前的系数比。根据上述原理,可得:vA:vB:vC:vD=1:3:2:1,由于vA=1mol·L-1·min-1,则:vC=2mol·L-1·min-1答案:C[例2]把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g),5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol·L-1·min-1则n的值为A、4B、3C、2D、1解析:根据反应速率与单位时间内物质的浓度变化之间的关系,可得:n(Z)=0.01mol·L-1·min-1×5min×2L=0.1mol,而5min末生成0.2molW,则说明Z与W在方程式中的系数比为1:2,即n=1答案:D[例3]反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。由此可推得,m、n值正确的是A、m=1,n=1B、m=,n=C、m=,n=1D、m=1,n=解析:本题给定的信息是:化学反应速率与反应物浓度之间的函数关系式。则根据题给信息可得:当c(Cl2)保持不变时,反应速率与c(H2)成正比,即m=1;而当c(H2)保持不变时,反应速率与c(Cl2)的平方根成正比,即n=1/2。答案:D[例4]某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。(1)由图中的数据分析,该反应的化学方程式为;(2)反应开始至2min、5minZ的平均反应速率为、;(3)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。解析:本题考查的是化学反应速率的图像题。通过题给信息判断反应物和生成物,及参加反应的各物质之间的物质的量之比,以及单位时间内各物质的浓度变化,判断反应的可逆性并计算反应速率。由图可知:反应物为X和Y,生成物为Z,5min时达平衡,消耗0.6molX同时消耗0.2mol的Y,生成0.4mol的Z,说明三者的物质的量之比为:3:1:2,方程式为:3X+Y2Z,2min时Z的平均反应速率为:0.2mol/2L/2min=0.05mol·(L·min)-1,5min时Z的平均反应速率为:0.4mol/2L/5min=0.04mol·(L·min)-1,由于5min后,单位时间内X、Y、Z的消耗速率和生成速率相同,达化学平衡状态,因此5min后Z的生成速率与5min末...