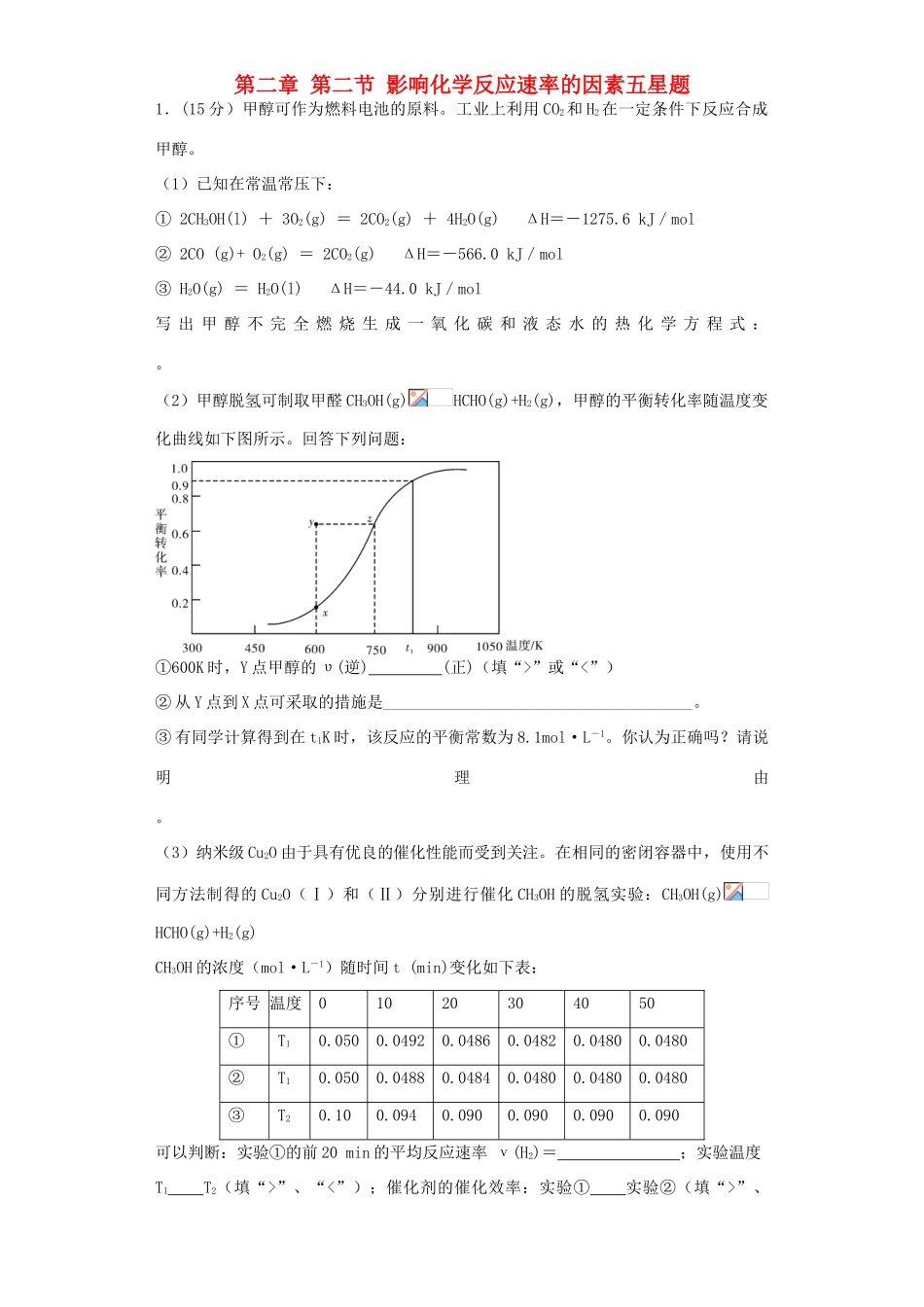
第二章第二节影响化学反应速率的因素五星题1.(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。(1)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH=-1275.6kJ/mol②2CO(g)+O2(g)=2CO2(g)ΔH=-566.0kJ/mol③H2O(g)=H2O(l)ΔH=-44.0kJ/mol写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。(2)甲醇脱氢可制取甲醛CH3OH(g)HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:①600K时,Y点甲醇的υ(逆)(正)(填“>”或“<”)②从Y点到X点可采取的措施是______________________________________。③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由。(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g)HCHO(g)+H2(g)CH3OH的浓度(mol·L-1)随时间t(min)变化如下表:序号温度01020304050①T10.0500.04920.04860.04820.04800.0480②T10.0500.04880.04840.04800.04800.0480③T20.100.0940.0900.0900.0900.090可以判断:实验①的前20min的平均反应速率ν(H2)=;实验温度T1T2(填“>”、“<”);催化剂的催化效率:实验①实验②(填“>”、“<”)。(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,则Co2+在阳极的电极反应式为;除去甲醇的离子方程式为。【答案】(15分)(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=﹣442.8kJ∕mol(2分)(2)①>(2分)②降低温度和增大压强(2分)③不正确(1分)。因为当CH3OH的起始浓度不同时,其转化率就不等于90%。(1分)(3)7.0×10-5mol·L-1min-1(2分)<(1分)<(1分)(4)Co2+-e-=Co3+(1分)6Co3++CH3OH+H2O==6Co2++CO2↑+6H+(2分)【解析】试题分析:(1)根据盖斯定律,(①-②)/2+③×2可得到甲醇不完全燃烧生成CO的热化学方程式,则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=(-1275.6+566)/2kJ/mol+(-44.0kJ/mol)×2=﹣442.8kJ∕mol;(2)①600K时,Y点的甲醇转化率大于平衡时甲醇的转化率,所以反应逆向进行,则υ(逆)>υ(正);②随温度升高,甲醇的转化率增大,说明该反应是吸热反应,若使平衡逆向移动,则需降低温度;该反应的正向是气体物质的量增大的方向,所以平衡逆向进行,还可以增大压强,使平衡逆向移动;③因为该图是随温度变化甲醇的转化率的变化,甲醇的起始物质的量不变,t1K时,甲醇的转化率是0.9,而甲醇的起始物质的量发生变化时,甲醇的转化率不是90%,所以该反应的平衡常数不能是8.1mol/L,不正确;(3)实验①的前20min时,甲醇的浓度减少(0.050-0.0486)mol/L=0.0014mol/L,则氢气的浓度增加0.0014mol/L,所以前20min时ν(H2)=0.0014mol/L/20min=7.0×10-5mol·L-1min-1;实验①与实验③相比,③达到平衡的时间较短,所以温度较高,则T1