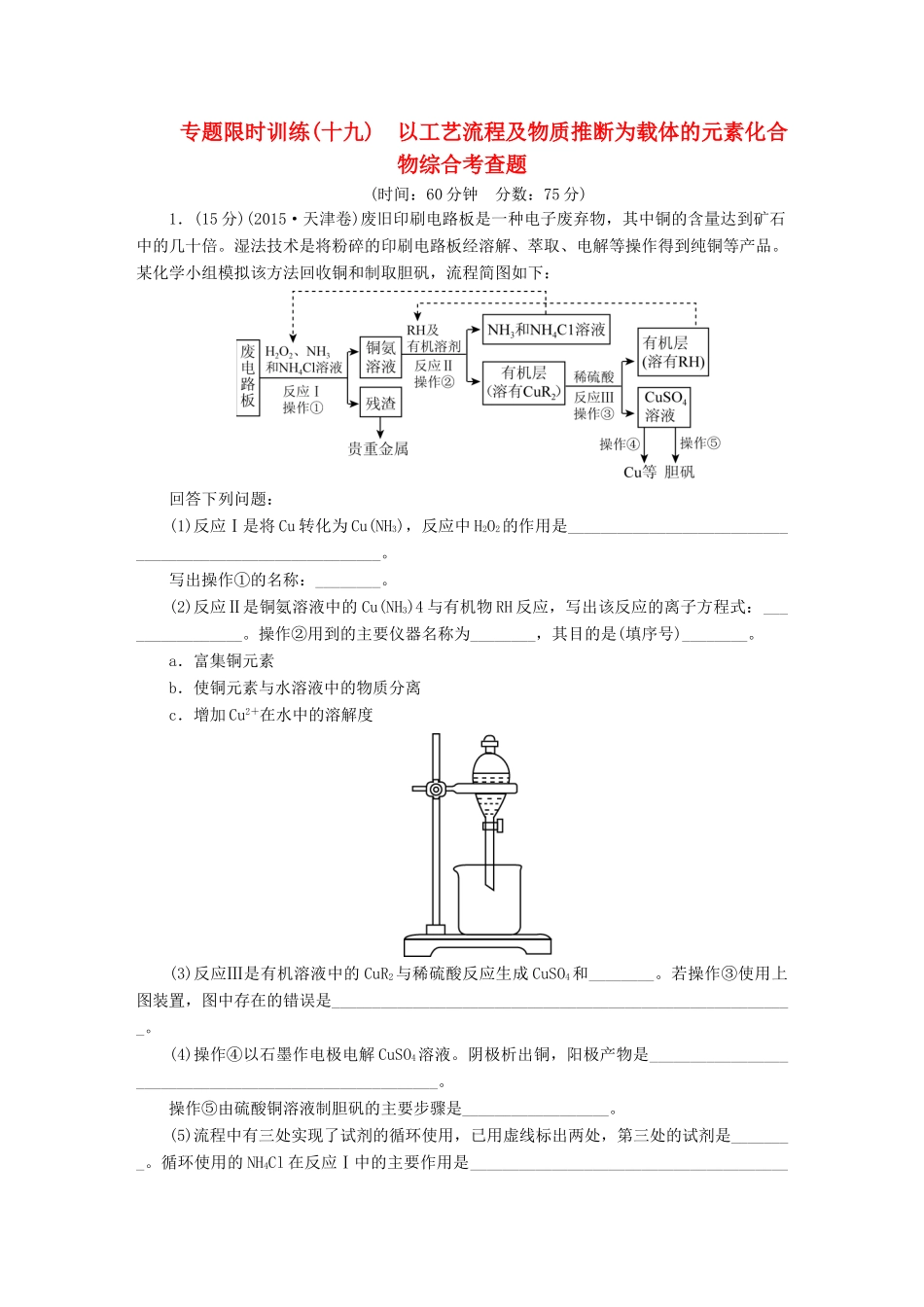
专题限时训练(十九)以工艺流程及物质推断为载体的元素化合物综合考查题(时间:60分钟分数:75分)1.(15分)(2015·天津卷)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:回答下列问题:(1)反应Ⅰ是将Cu转化为Cu(NH3),反应中H2O2的作用是_________________________________________________________。写出操作①的名称:________。(2)反应Ⅱ是铜氨溶液中的Cu(NH3)4与有机物RH反应,写出该反应的离子方程式:________________。操作②用到的主要仪器名称为________,其目的是(填序号)________。a.富集铜元素b.使铜元素与水溶液中的物质分离c.增加Cu2+在水中的溶解度(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和________。若操作③使用上图装置,图中存在的错误是_________________________________________________________。(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是______________________________________________________。操作⑤由硫酸铜溶液制胆矾的主要步骤是__________________。(5)流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。循环使用的NH4Cl在反应Ⅰ中的主要作用是_________________________________________________________。答案:(1)作氧化剂过滤(2)Cu(NH3)4+2RH===2NH4+2NH3+CuR2分液漏斗ab(3)RH分液漏斗尖端未紧靠烧杯内壁、液体过多(4)O2、H2SO4加热浓缩、冷却结晶、过滤(5)H2SO4防止由于溶液中c(OH-)过高,生成Cu(OH)2沉淀解析:(1)Cu转化为Cu(NH3)4,化合价升高,发生氧化反应,故H2O2作氧化剂,将Cu氧化。从图中可以看出,经过操作①得到溶液和残渣,故操作①是过滤。(2)铜氨溶液中的Cu(NH3)4与有机物RH反应生成NH3和NH4Cl及溶解在有机层中的CuR2,故反应的离子方程式为Cu(NH3)4+2RH===2NH3+2NH4+CuR2。操作②得到溶液和有机层,故该操作是分液,用到的主要仪器是分液漏斗。其目的是使铜元素与水溶液中的物质分离,富集铜元素。(3)根据反应Ⅲ可以判断出CuR2与稀硫酸反应生成CuSO4和RH。图中的错误是分液漏斗的尖端未紧靠烧杯内壁,分液漏斗中的液体太多。(4)电解CuSO4溶液,阳极是水放电,电极反应式为2H2O-4e-===O2↑+4H+,故阳极产物是O2和H2SO4。将硫酸铜溶液加热浓缩、冷却结晶、过滤即得胆矾晶体。(5)反应Ⅲ消耗H2SO4,操作④电解CuSO4溶液产生H2SO4,实现了H2SO4的循环使用。反应Ⅰ中H2O2将铜氧化为Cu2+,Cu2+与NH3产生Cu(NH3)4,因为NH3溶于水,溶液显碱性,如果c(OH-)过高,会产生Cu(OH)2沉淀,为了防止产生Cu(OH)2沉淀,在反应Ⅰ中加入了NH4Cl。2.(15分)锌焙砂是锌精矿经焙烧后所得的产物,以锌焙砂为原料制取金属锌的流程如图所示。已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。②Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅶ)。请回答下列问题:(1)ZnFe2O4中Fe的化合价为________,酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。②25℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=________mol·L-1(已知25℃时,Ksp[Fe(OH)3]=4.0×10-38)。(3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式__________________________________________________________;电解时不断补充电解液的目的是_________________________。(4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式__________________。答案:(1)+3ZnFe2O4+4H2SO4===ZnSO4+Fe2(SO4)3+4H2O(2)①H2O2+2Fe2++2H+===2Fe3++2H2O②4.0×10-5(3)4OH--4e-===2H2O...