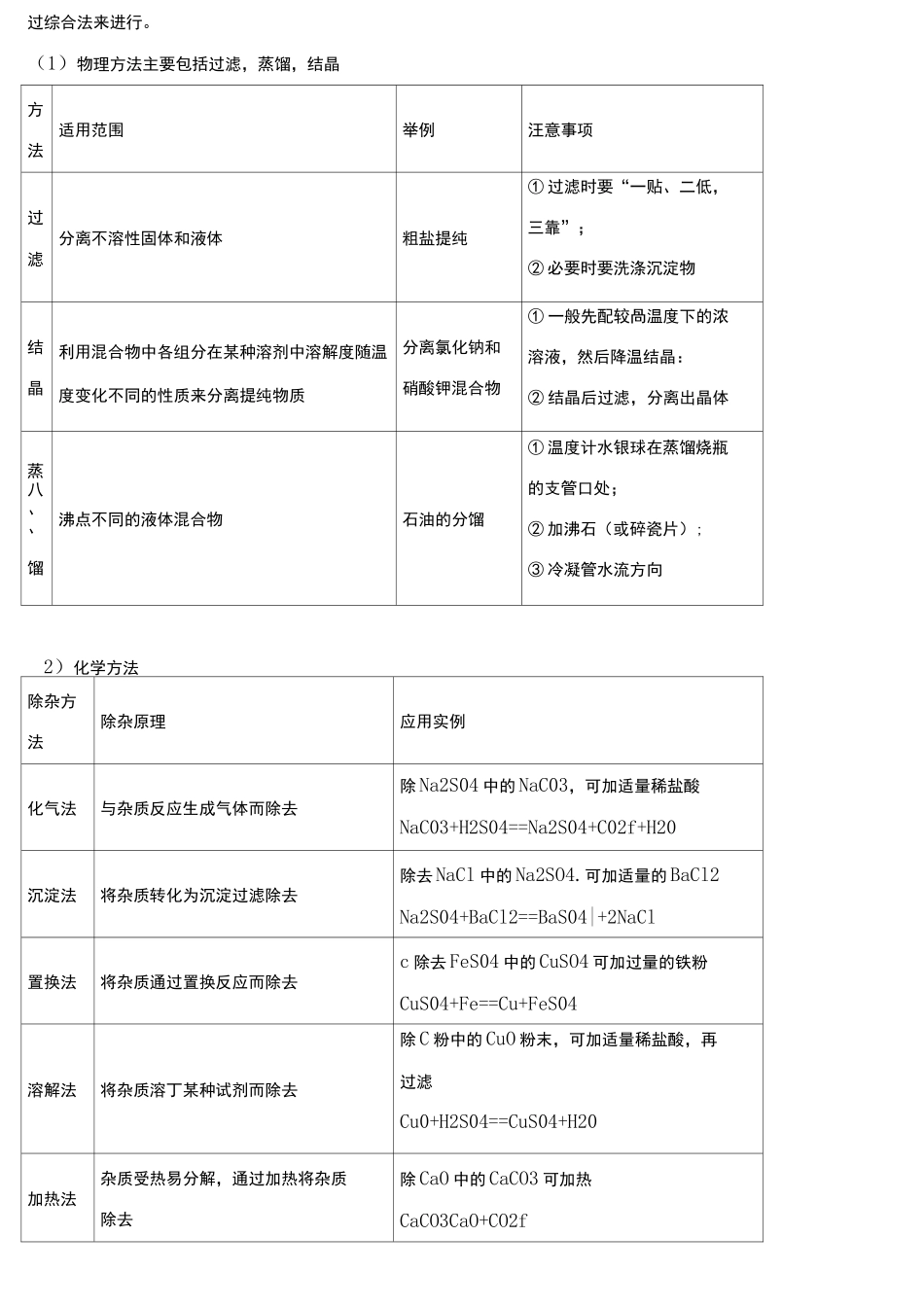
初中化学物质的除杂知识点总结混合物的分离和提纯(除杂)1.分离与提纯的基本原理(1)分离:就是用物理或化学的方法将混合物巾的各组分分开,并将物质恢复到原状态。(2)提纯和除杂:用物理或化学的方法把混合物中的杂质除去而得到纯物质。在提纯过程中,如果杂质发生了化学变化,不必恢复成原物质。二者的方法在很多情况下是相似的,但分离比提纯的步骤要多,因为各组分均要保留,绎过化学反应使混合物中各组分经转化而分离后还要复原为原来的组分物质提纯和除杂过程中经常用到分离操作,二者有时又密不可分。2.分离和提纯应遵循的原则(1)不能“玉石俱焚”:即试剂一般要求与杂质反应,不与要保留的物质反应。但在特殊情况下,所加试剂可和保留物质应应,但最终要转化成需要保留的物质如除去FeCl,溶液中的NaCl,可加过量3的NaOH溶液一过滤一洗涤一加适量稀盐酸。⑵“不增““不减”:即不增加新的杂质,不减少要保留的物质如除去FeCl中的少量Fe(SO)应3243选用BaCl而不应选用Ba(NO),否则发生反应3Ba(NO)+Fe(SO)==3BaSO!+2Fe(NO)溶液中又增23232243433加了Fe(NO).33(3)易分离:反应后,物质的状态不同,便于分离。(4)不污染环境:即耍求所选用的除杂方法不能产生可污染环境的物质。(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。常见除杂的方法:CO(O):将气体通过灼热的铜网22CO(H或CO):将气体通过灼热的氧化铜22O或CO或H(含HO):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂2222O或H或CO(含CO或SO):将气体通入氢氧化钠溶液中2222Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤Fe(含Cu):用磁铁将铁粉吸引出来Cu(含CuO),Fe(含FeO):高温下与H或CO反应232CuO(含Cu或C):在空气中灼烧CaO(含CaCO):高温煅烧(CaCO分解成CaO和CO)332CaCO(含CaO):加足量水溶解,过滤,取滤渣3Ca(OH)(含CaO)加足量水2FeSO溶液(含HSO或CuSO),FeCl溶液(含盐酸或CuCl):加过量铁粉,过滤,取滤液424422NaCl溶液(含NaCO):加适量稀盐酸23NaSO溶液(含CuSO):加适量NaOH溶液244酸、碱、盐溶液的除杂技巧:1.被提纯物与杂质所含阳离子相同时,选取与杂质中的阴离子不共存的阳离子,再与被提纯物中的阴离子组合出除杂试剂。如除去NaSO溶液中的NaOH:可选用稀HSO溶液为除杂试剂(2NaOH+2424HSO==NaSO+2HO)、除去KCl溶液中的KSO:可选用BaCl溶液为除杂试制(KSO+BaCl24242242242==2KCl+BaSOI,过滤除去)42.被提纯物与杂质所含阴离子相同时,选取与杂质中阳离子不共存的阴离子,再与被提纯物中的阳离子组合出除杂试剂,如除去NaCl溶液中的BaCl:可选用NaSO溶液为除杂试剂224(BaCl+NaSO=BaSOI+2NaCl,过滤除去).再如除去KNO溶液中的AgNO:可选用KCl溶液为除杂试224433剂(AgNO+KCl=AgCl|+KNO,过滤除去)。333.被提纯物质与杂质所含阴离子、阳离子都不相同时,应选取与杂质中阴、阳离子都不共存的阳、阴离子组合出除杂试剂。如:除去NaCl溶液中的CuSO:可选用Ba(OH)溶液为除杂试剂[CuSO+Ba(OH)=4242BaSOI+Cu(OH)I,过滤除去]。42分离和提纯的方法:物质的分离和提纯有两种主要的方法,即物理方法和化学方法。实际上在实验过程中往往需通过综合法来进行。(1)物理方法主要包括过滤,蒸馏,结晶方法适用范围举例汪意事项过滤分离不溶性固体和液体粗盐提纯①过滤时要“一贴、二低,三靠”;②必要时要洗涤沉淀物结晶利用混合物中各组分在某种溶剂中溶解度随温度变化不同的性质来分离提纯物质分离氯化钠和硝酸钾混合物①一般先配较咼温度下的浓溶液,然后降温结晶:②结晶后过滤,分离出晶体蒸八、、馏沸点不同的液体混合物石油的分馏①温度计水银球在蒸馏烧瓶的支管口处;②加沸石(或碎瓷片);③冷凝管水流方向2)化学方法除杂方法除杂原理应用实例化气法与杂质反应生成气体而除去除Na2S04中的NaC03,可加适量稀盐酸NaC03+H2S04==Na2S04+C02f+H20沉淀法将杂质转化为沉淀过滤除去除去NaCl中的Na2SO4.可加适量的BaCl2Na2S04+BaCl2==BaS04|+2NaCl置换法将杂质通过置换反应而除去c除去FeS04中的CuSO4可加过量的铁粉CuS04+Fe==Cu+FeS04溶解法将杂质溶丁某种试剂而除去除C粉中...