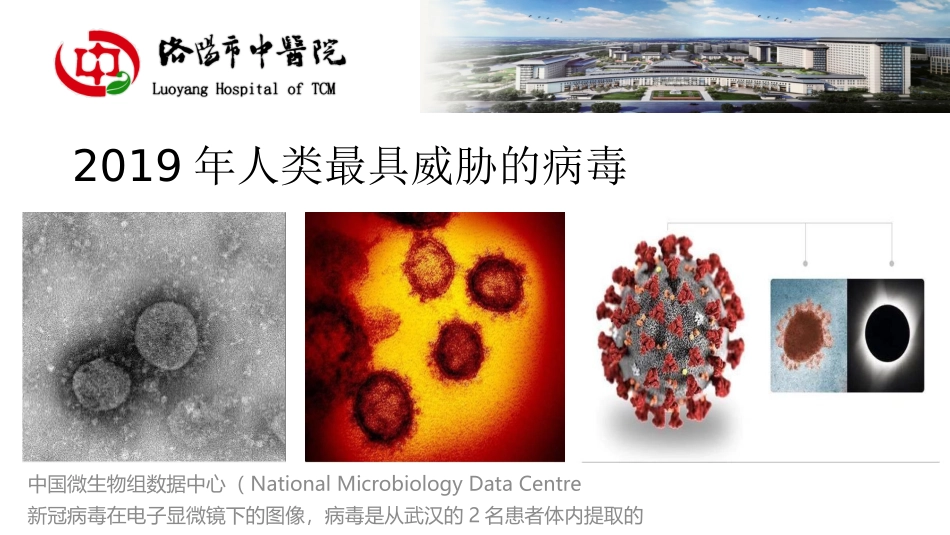
新冠肺炎COVID-19呼吸衰竭病理基础洛阳市中医院重症医学科(西工院)王庆新型冠状病毒SARS-CoV-2截止昨天全球已经有确诊病例751万累计死亡病例98万,其中印度昨天新增9万人,美国昨天新增4.5万人。世界形势仍没有减弱的趋势。短短的半年时间就死亡近百万人,一条条鲜活生命的逝去要求必须我们尽快了解病毒做出正确的防疫最后成功治愈战胜病毒。2019年人类最具威胁的病毒中国微生物组数据中心(NationalMicrobiologyDataCentre新冠病毒在电子显微镜下的图像,病毒是从武汉的2名患者体内提取的SARS-CoV-2新型冠状病毒(2019-nCoV)属于β属的冠状病毒,有包膜,颗粒呈圆形或椭圆形,直径60~140nm。具有5个必需基因,分别针对核蛋白(N)、病毒包膜(E)、基质蛋白(M)和刺突蛋白(S)4种结构蛋白及RNA依赖性的RNA聚合酶(RdRp)。核蛋白(N)包裹RNA基因组构成核衣壳,外面围绕着病毒包膜(E),病毒包膜包埋有基质蛋白(M)和刺突蛋白(S)等蛋白。通过其表面刺突的S蛋白与细胞膜表面的ACE2结合,侵染宿主细胞,病毒在进入细胞后进行病毒复制、扩增、释放的同时启动机体的防御反应和疾病过程。ACE2在人体各个组织广泛表达,在肺泡上皮、小肠上皮和血管内皮细胞的表达尤为丰富,SARS-CoV-2感染人体后可引起以肺脏损伤为主的全身多器官损伤。新型冠状病毒96个小时左右即可在人呼吸道上皮细胞内发现,而在VeroE6和Huh-7细胞系中分离培养约需4~6天。•为什么病人会出现呼吸道以外的消化道症状的原因。腹泻的原因!新型冠状病毒SARS-CoV-2COVID-19肺炎病人肺部解剖肺脏呈不同程度的实变。实变区主要呈现弥漫性肺泡损伤和渗出性肺泡炎。不同区域肺病变复杂多样,新旧交错。肺泡腔内见浆液、纤维蛋白性渗出物及透明膜形成;渗出细胞主要为单核和巨噬细胞,可见多核巨细胞。II型肺泡上皮细胞增生,部分细胞脱落。II型肺泡上皮细胞和巨噬细胞内偶见包涵体。肺泡隔可见充血、水肿,单核和淋巴细胞浸润。少数肺泡过度充气、肺泡隔断裂或囊腔形成。肺内各级支气管黏膜部分上皮脱落,腔内可见渗出物和黏液。小支气管和细支气管易见黏液栓形成。可见肺血管炎、血栓形成(混合血栓、透明血栓)和血栓栓塞。肺组织易见灶性出血,可见出血性梗死、细菌和(或)真菌感染。病程较长的病例,可见肺泡腔渗出物机化(肉质变)和肺间质纤维化。电镜下支气管黏膜上皮和II型肺泡上皮细胞胞质内可见冠状病毒颗粒。免疫组化染色显示部分支气管黏膜上皮、肺泡上皮细胞和巨噬细胞呈新型冠状病毒抗原免疫染色和核酸检测阳性。来源于卞修武院士系统尸检37例微创尸检54例(COVID-19)病理生理基础COVID-19是由SARS-COV-2引起的以肺为主要靶器官的全身多器官损伤性疾病,其病理生理机制与SARS、中东呼吸综合征(MERS)等疾病相似,都涉及炎症、发热、缺氧、水、电解质、酸碱平衡紊乱、休克等多个基本病理过程。免疫细胞过度活化、细胞因子风暴、过度氧化应激可能是COVID-19、SARS和MERS等疾病引起ARDS、脓毒症休克及多器官功能衰竭并导致死亡的共同病理生理基础。(COVID-19)肺炎病理生理基础1炎症激活肺间质损伤水肿(血管通透性增加)2血栓形成3Ⅱ型肺泡上皮细胞的损害4ARDS成人呼吸窘迫综合征(COVID-19)肺炎病理生理基础炎症反应1.血流动力学改变细动脉短暂收缩(几秒神经)2.血管扩张血流加速(持续时间不等,由组胺NO等)结果局部发热发红3.血流速度减慢(持续数十分钟红细胞浓集血流阻力加大,白细胞边集粘附血管内皮并渗出到血管外)结果局部水肿炎症引起血管通透性增加•1.炎症刺激血管内皮通过血管内皮细胞,发生血管内皮细胞的收缩,内皮细胞出现缝隙•2.内皮细胞损伤一方面是创伤、感染直接引起内皮细胞坏死及脱落•3.边集的白细胞释放蛋白水解酶进一步损害内皮细胞最后大量白细胞,淋巴细胞,补体,激肽,内源性凝血等促进炎症的局限化,加速了康复炎症引起血管通透性增加•血管通透性增加导致血液渗出物的增加,根据主要渗出物的种类分为:1.浆液性渗出2.纤维素性渗出3.化脓性渗出4.出血性渗出而(COVID-19)新冠肺炎引起肺部渗出主体是血浆蛋白大量的纤维蛋白是引起ARDS透明膜的主要成分,即使康复之后也引起肺纤维化...