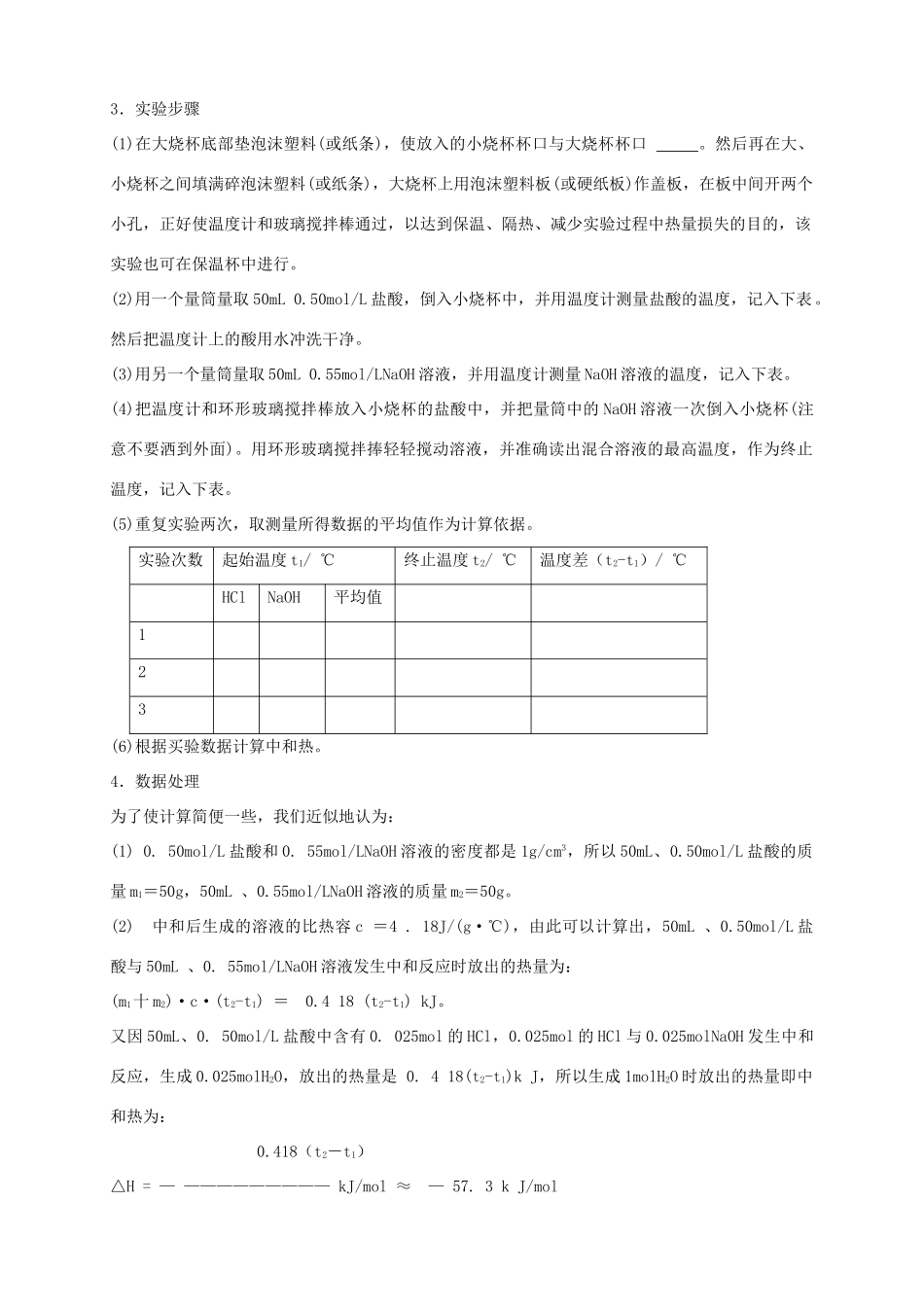
第一节 化学反应与能量的变化(学案) 第 三课 时【学习目标】: 认识中和热的概念,掌握中和热的测定原理及方法。【重、难点】: 中和热的测定实验【学习过程】三、中和热1.定义:在稀溶液中,酸跟碱发生中和反应而生成 mol H2O,这时的反应热叫中和热。2.强酸与强碱的中和反应其实质是 H+ 和 OH- 反应,其热化学方程式为:H+(aq) +OH-(aq) = H2O(l) ΔH = -57.3kJ/mol3. 注意:①. 中和热是以生成 1molH2O 为基准,因为表示中和热的热化学方程式中,水的化学计量数为 1,其酸、碱或盐的化学计量数可以为分数.必须以生成 1mol 水为标准;强酸与强碱中和时生成 1mol H2O 均放热 57.3kJ,弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。浓的强酸与强碱中和时,稀释过程放热,所以它们参加中和反应时的中和热大于57.3kJ/mol。弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于 57.3kJ/mol。②. 中和反应对象为稀溶液。这里的稀溶液一般要求酸溶液中的 c(H +)≤1mol/L,碱溶液中的c(OH -)≤1mol/L。这是因浓酸溶液和浓碱溶液稀释时会放出热量。四、中和热的测定实验1.实验用品大烧杯 个(500mL)、小烧杯 个(100mL)、温度计、量筒 个(50mL)、泡沫塑料或硬纸条、泡沫塑料板或硬纸板(中心有 个小孔)、 搅拌棒。0.50mol/L 盐酸、0.55mol/LNaOH 溶液。2.实验原理实验原理: 用 50 mL(大约 50g) 0. 50 mol/L 的盐酸与 50mL (大约 50g) 0. 55 mol/L 氢氧化钠 设 t1: 反应前两溶液的平均温度。 t2: 反应后溶液温度 c = 4 .18 J/(g·℃)试求 Q 的表达式和中和热表达式 :Q = mc (t2-t1) = 0.418(t2-t1)kJ 0.418(t2-t1)△H = — ————————— kJ/mol 0.025H+(aq)十 OH-(aq) = H2O(1);△H ≈ — 57.3kJ/mol3.实验步骤(1)在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口 。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,该实验也可在保温杯中进行。(2)用一个量筒量取 50mL 0.50mol/L 盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。(3)用另一个量筒量取 50mL 0.55mol/LNaOH ...