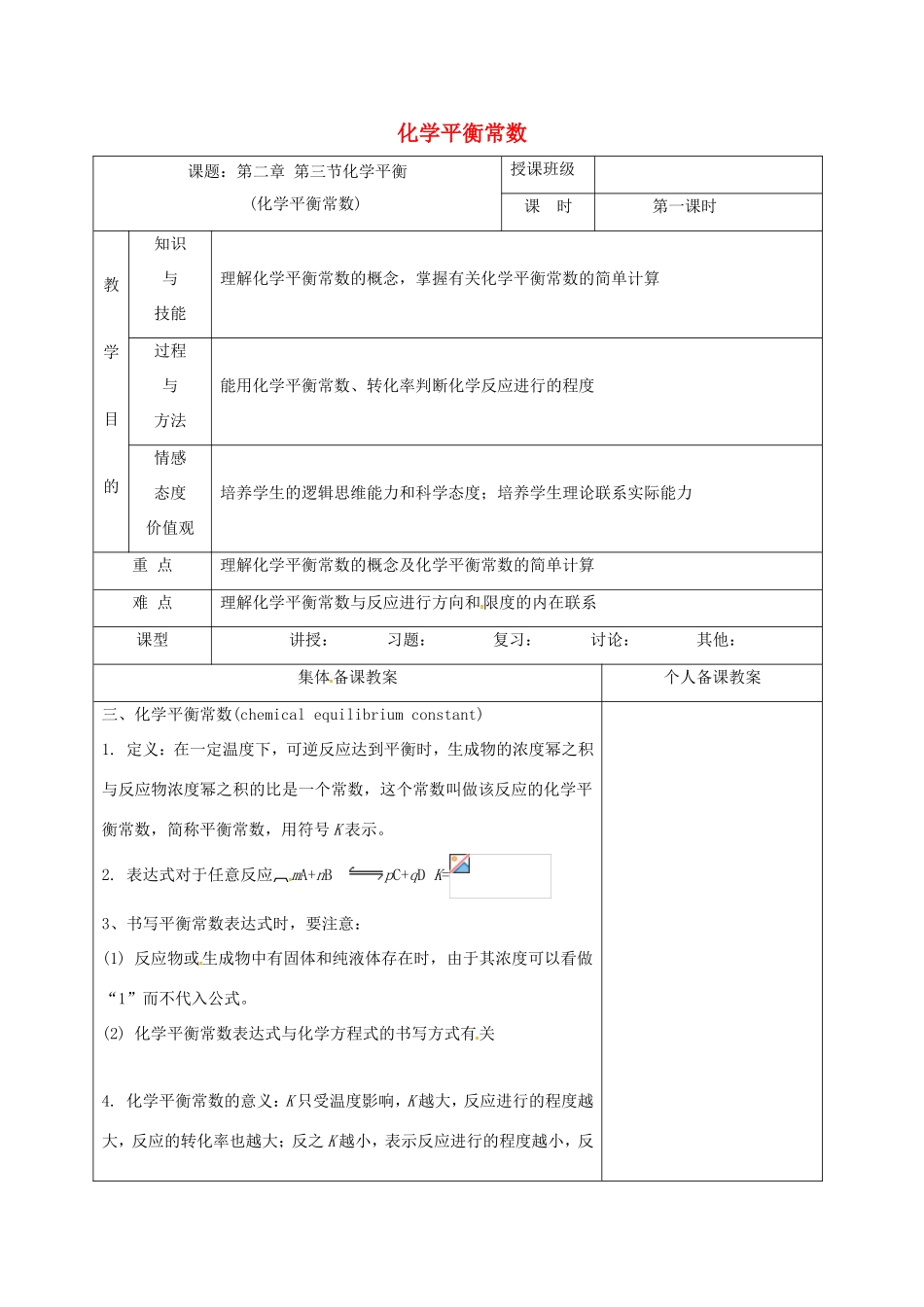
化学平衡常数课题:第二章第三节化学平衡(化学平衡常数)授课班级课时第一课时教学目的知识与技能理解化学平衡常数的概念,掌握有关化学平衡常数的简单计算过程与方法能用化学平衡常数、转化率判断化学反应进行的程度情感态度价值观培养学生的逻辑思维能力和科学态度;培养学生理论联系实际能力重点理解化学平衡常数的概念及化学平衡常数的简单计算难点理解化学平衡常数与反应进行方向和限度的内在联系课型讲授:习题:复习:讨论:其他:集体备课教案个人备课教案三、化学平衡常数(chemicalequilibriumconstant)1.定义:在一定温度下,可逆反应达到平衡时,生成物的浓度幂之积与反应物浓度幂之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。2.表达式对于任意反应mA+nBpC+qDK=3、书写平衡常数表达式时,要注意:(1)反应物或生成物中有固体和纯液体存在时,由于其浓度可以看做“1”而不代入公式。(2)化学平衡常数表达式与化学方程式的书写方式有关4.化学平衡常数的意义:K只受温度影响,K越大,反应进行的程度越大,反应的转化率也越大;反之K越小,表示反应进行的程度越小,反应物的转化率也越小。5、化学平衡常数的应用(1)平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。K值越大,表示反应进行得越完全,反应物转化率越大;K值越小,表示反应进行得越不完全,反应物转化率越小。(2)判断正在进行的可逆是否平衡及反应向何方向进行:对于可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定的温度下的任意时刻,反应物的浓度和生成物的浓度有如下关系:Qc=Cp(C)·Cq(D)/Cm(A)·Cn(B),叫该反应的浓度商。Qc<K,V正>V逆,反应向正反应方向进行Qc=K,V正==V逆,反应处于平衡状态Qc>K,V正