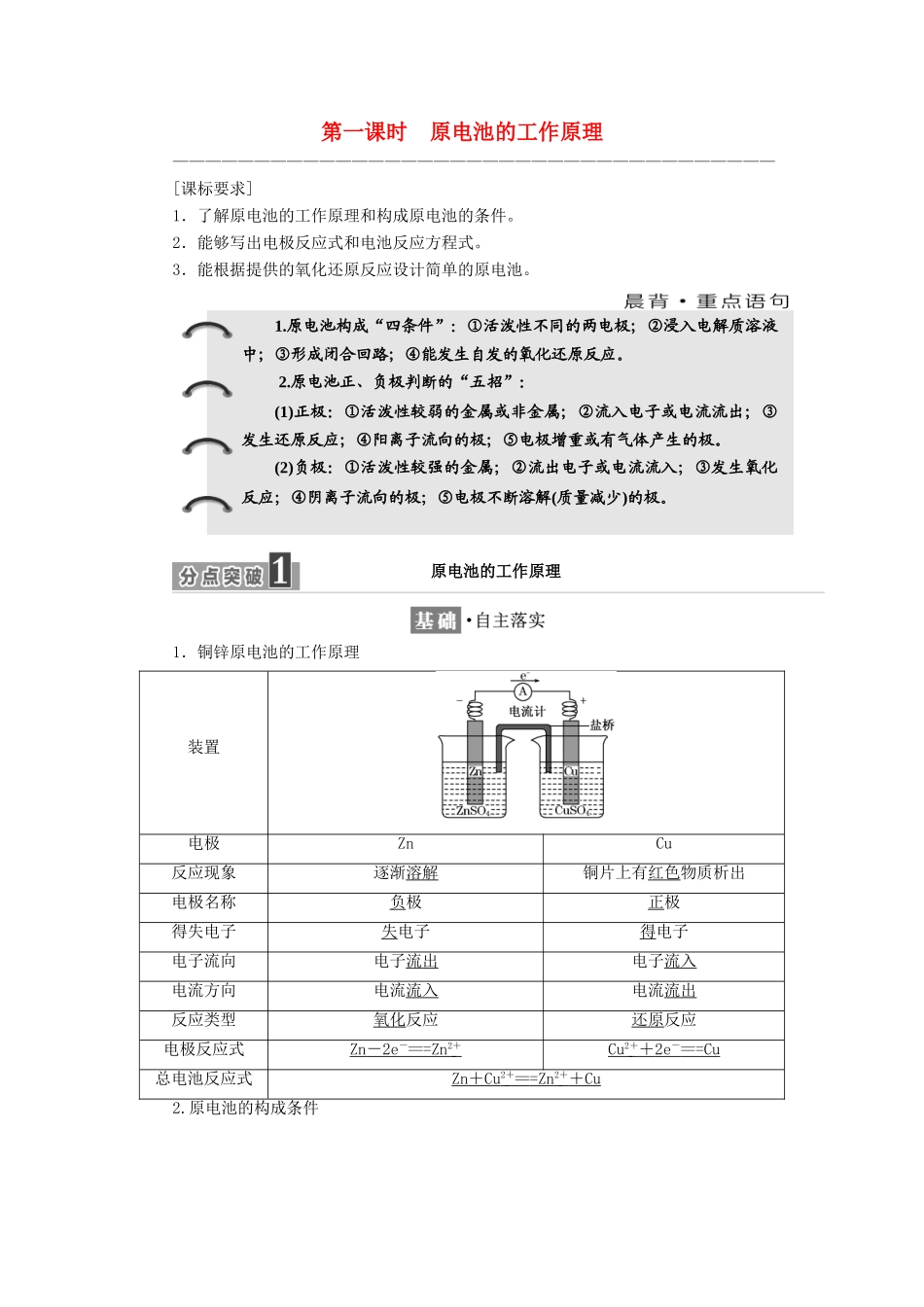
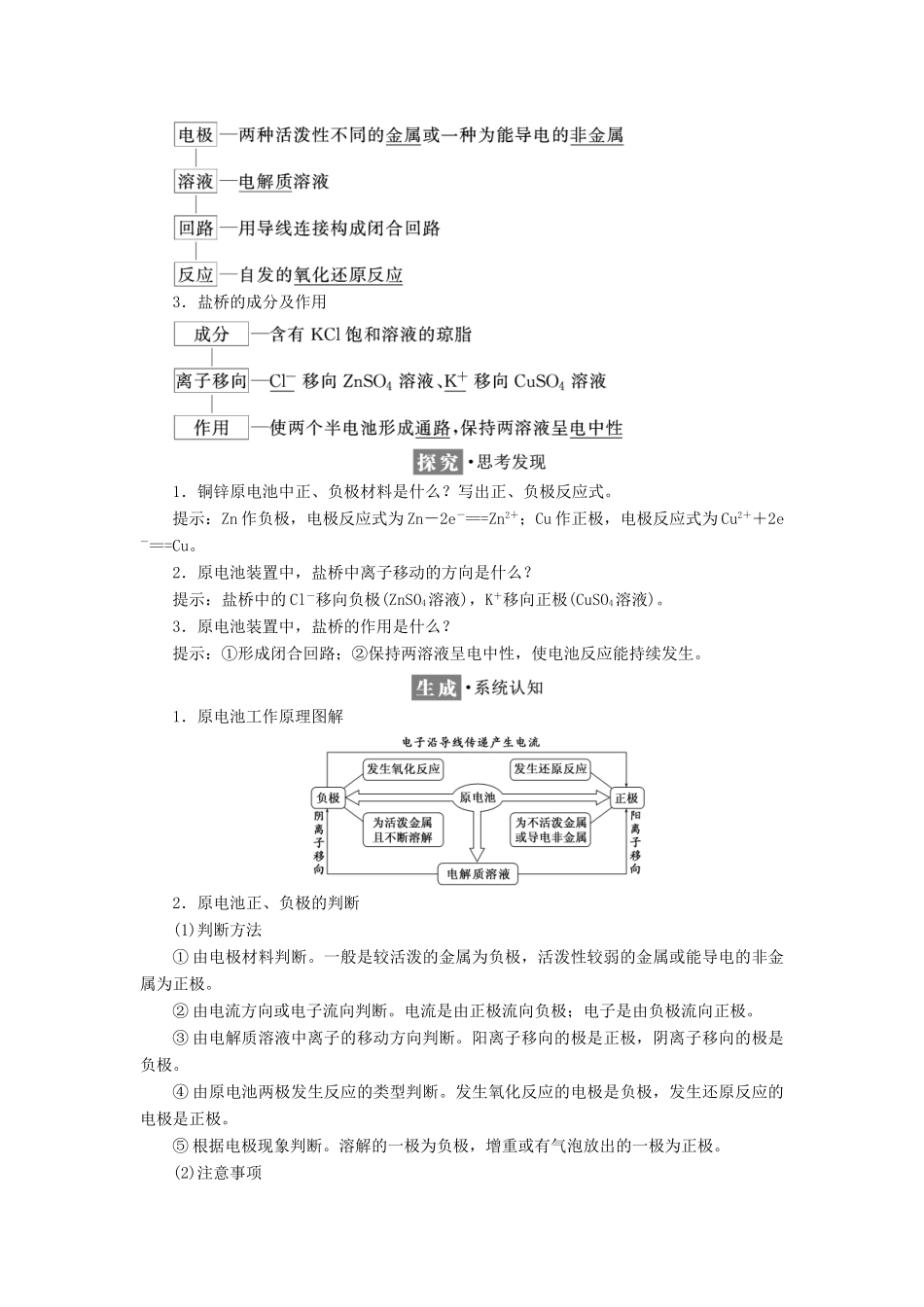
第一课时原电池的工作原理—————————————————————————————————————[课标要求]1.了解原电池的工作原理和构成原电池的条件。2.能够写出电极反应式和电池反应方程式。3.能根据提供的氧化还原反应设计简单的原电池。1.铜锌原电池的工作原理装置电极ZnCu反应现象逐渐溶解铜片上有红色物质析出电极名称负极正极得失电子失电子得电子电子流向电子流出电子流入电流方向电流流入电流流出反应类型氧化反应还原反应电极反应式Zn-2e-===Zn2+Cu2++2e-===Cu总电池反应式Zn+Cu2+===Zn2++Cu2.原电池的构成条件1.原电池构成“四条件”:①活泼性不同的两电极;②浸入电解质溶液中;③形成闭合回路;④能发生自发的氧化还原反应。2.原电池正、负极判断的“五招”:(1)正极:①活泼性较弱的金属或非金属;②流入电子或电流流出;③发生还原反应;④阳离子流向的极;⑤电极增重或有气体产生的极。(2)负极:①活泼性较强的金属;②流出电子或电流流入;③发生氧化反应;④阴离子流向的极;⑤电极不断溶解(质量减少)的极。原电池的工作原理3.盐桥的成分及作用1.铜锌原电池中正、负极材料是什么?写出正、负极反应式。提示:Zn作负极,电极反应式为Zn-2e-===Zn2+;Cu作正极,电极反应式为Cu2++2e-===Cu。2.原电池装置中,盐桥中离子移动的方向是什么?提示:盐桥中的Cl-移向负极(ZnSO4溶液),K+移向正极(CuSO4溶液)。3.原电池装置中,盐桥的作用是什么?提示:①形成闭合回路;②保持两溶液呈电中性,使电池反应能持续发生。1.原电池工作原理图解2.原电池正、负极的判断(1)判断方法①由电极材料判断。一般是较活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。②由电流方向或电子流向判断。电流是由正极流向负极;电子是由负极流向正极。③由电解质溶液中离子的移动方向判断。阳离子移向的极是正极,阴离子移向的极是负极。④由原电池两极发生反应的类型判断。发生氧化反应的电极是负极,发生还原反应的电极是正极。⑤根据电极现象判断。溶解的一极为负极,增重或有气泡放出的一极为正极。(2)注意事项原电池的电极类型不仅跟电极材料有关,还与电解质溶液的性质有关。如镁铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;而镁铝电极在氢氧化钠溶液中构成原电池,铝为负极,镁为正极;FeCu浓HNO3构成的原电池,Fe钝化,而Cu作负极。3.带盐桥原电池装置中两个“半电池”以锌铜原电池为例,如图所示:(1)ZnZnSO4半电池:在ZnSO4溶液中,锌片逐渐溶解,即Zn被氧化,锌原子失去电子,形成Zn2+进入溶液,即Zn-2e-===Zn2+;从锌片上释放出的电子,经过导线流向铜片。(2)CuCuSO4半电池:CuSO4溶液中的Cu2+从铜片上得到电子,还原为铜单质并沉积在铜片上,即Cu2++2e-===Cu。(3)盐桥的作用:电池工作时,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使两溶液均保持电中性。当取出盐桥后,形成断路,反应停止。1.关于如图所示装置的叙述,正确的是()A.铜是负极,铜片上有气泡产生B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.氢离子在铜片表面被还原解析:选D由所给图示可知,Zn为原电池负极,失去电子被氧化,电子经导线流向正极铜电极,溶液中的氢离子在正极得到电子而被还原为H2;电流方向与电子流动的方向相反。2.铜锌原电池(如下图)工作时,下列叙述正确的是()A.正极反应为Zn-2e-===Zn2+B.电池反应为Zn+Cu2+===Zn2++CuC.在外电路中,电子从负极流向正极D.盐桥中的K+移向ZnSO4溶液解析:选BCA项,正极发生还原反应:Cu2++2e-===Cu,负极发生氧化反应:Zn-2e-===Zn2+;B项,由正、负两极发生的电极反应合并得总反应:Zn+Cu2+===Zn2++Cu;C项,电子流向为负极沿导线到正极;D项,由于Cu2+放电,为使CuSO4溶液保持电中性,则盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液。1.加快化学反应速率构成原电池的反应速率比直接接触的反应速率快。如实验室制H2时,粗锌比纯锌与稀硫酸反应快,或向溶液中滴入几滴CuSO4溶液,反应加快。2.比较金属的活动性强弱(1)对于酸性电解质,一般是作负极...