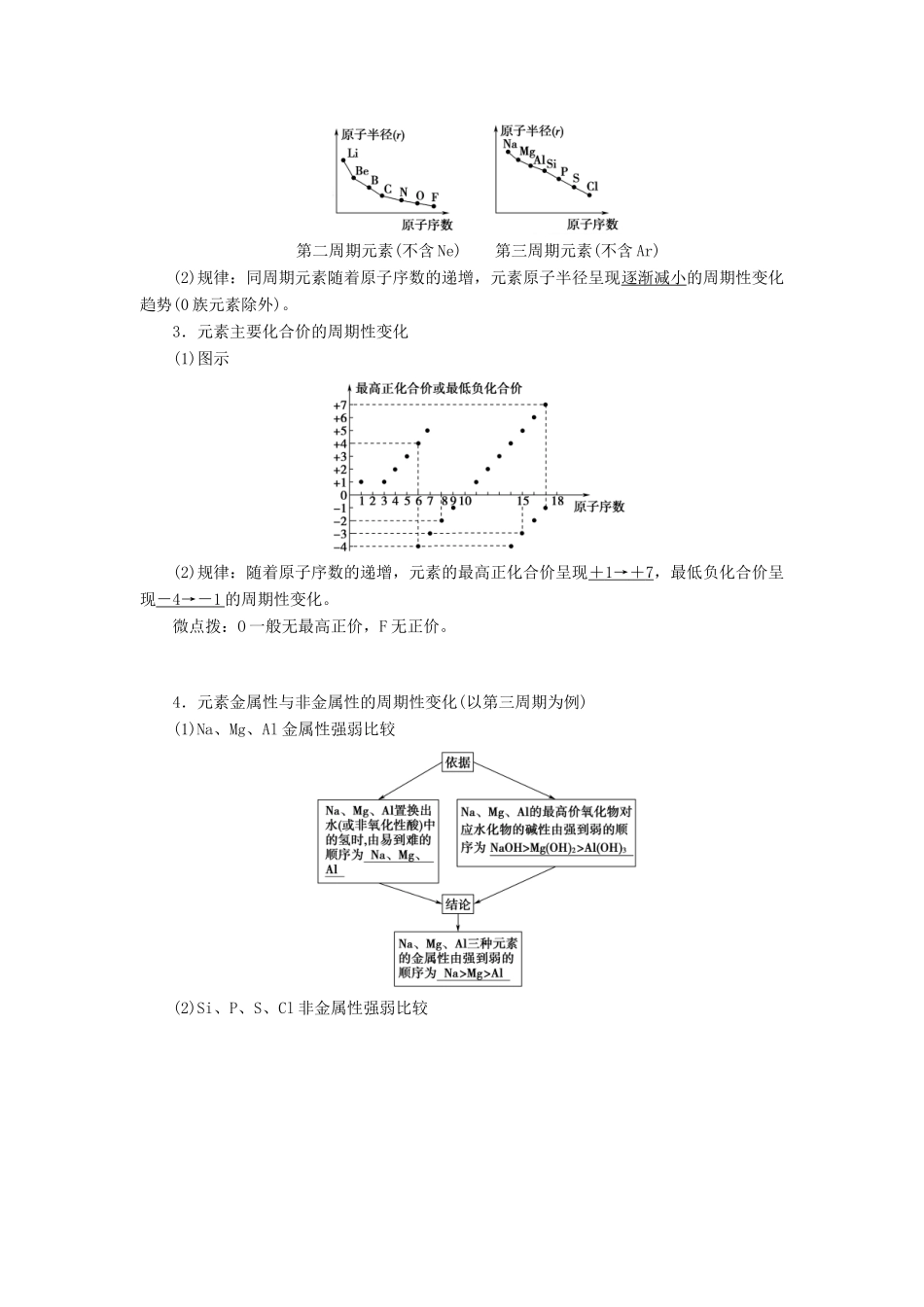
课时1原子核外电子的排布元素周期律目标与素养:1.了解核外电子的分层排布规律及表示方法。(微观探析与模型认知)2.了解元素的原子结构与性质的周期性变化规律,理解元素周期律的内容及实质。(宏观辨识与证据推理)一、原子核外电子排布1.电子层的划分(1)核外电子的能量及运动区域(2)电子层及其与能量的关系各电子层(由内到外)序号(n)1234567符号KLMNOPQ与原子核的距离由近到远能量由低到高2.核外电子的排布规律(1)电子总是尽可能地先从内层排起,当一层充满后再填充下一层,即原子核外电子排布时,先排K层,充满后再填充L层。(2)原子核外各电子层最多容纳2n2个电子。(3)原子最外层电子数不能超过8(K层为最外层时不能超过2),次外层电子数不能超过18。违背了哪些规律?[答案]能量最低原理,最外层电子不超过8个。二、元素周期律1.原子核外电子排布的周期性变化(1)第一周期最外层电子数由1→2。(2)第二周期最外层电子数由1→8。(3)第三周期最外层电子数由1→8。规律:随着原子序数的递增,元素原子的最外层电子数呈现1~8的周期性变化(第一周期除外)。2.元素原子半径的周期性变化(1)图示第二周期元素(不含Ne)第三周期元素(不含Ar)(2)规律:同周期元素随着原子序数的递增,元素原子半径呈现逐渐减小的周期性变化趋势(0族元素除外)。3.元素主要化合价的周期性变化(1)图示(2)规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。微点拨:O一般无最高正价,F无正价。4.元素金属性与非金属性的周期性变化(以第三周期为例)(1)Na、Mg、Al金属性强弱比较(2)Si、P、S、Cl非金属性强弱比较(3)同周期元素性质的递变规律随着原子序数的递增5.元素周期律(1)内容:元素的性质随着原子序数的递增而呈周期性变化。(2)实质:元素性质的周期性变化是核外电子排布周期性变化的必然结果。1.判断对错(对的打“√”,错的打“×”)。(1)核外电子的能量不同,能量高的在离核近的区域运动()(2)表示氩原子的结构示意图()(3)O、F的原子半径是F>O,非金属性F>O()(4)NaOH、Mg(OH)2、Al(OH)3的碱性逐渐减弱()[提示](1)×(2)×(3)×(4)√2.核电荷数为1~18的元素中,下列说法正确的是()A.最外层只有1个电子的元素一定是金属元素B.最外层有2个电子的元素一定是金属元素C.原子核外各层电子数相等的元素一定是金属元素D.最外层电子数为7的原子,最高正价为+7价[答案]C3.在第三周期元素中,除稀有气体元素外:(1)原子半径最小的元素是________(填元素符号,下同)。(2)元素化合价最高的是________,其相应的氧化物的化学式为________________。(3)元素化合价最低的是________,其相应氢化物的化学式为________________。[答案](1)Cl(2)ClCl2O7(3)SiSiH4核外电子排布与等电子粒子1.原子核外电子排布规律的“四最”(1)“一个最低”——能量最低原理:核外电子总是尽可能地先排布在能量最低的电子层。(2)“三个最多”——各电子层的电子排布规律①各电子层最多容纳的电子数是2n2个。②最外层电子数最多是8个(K层是最外层时,最多不超过2个)。③次外层电子数最多是18个。微点拨:(1)以上规律相互联系,不能孤立地去理解,如M层不是最外层时,其容纳的电子数最多为18,当其为最外层时,其容纳的电子数最多不超过8。(2)原子最外层电子数为8(He为2个)时为稳定结构,当最外层电子不满8个(或2个)时为不稳定结构,不稳定结构在一定条件下可以变为稳定结构。2.原子或离子结构示意图――→――→⇓⇓⇓⇓⇓⇓质子数>电子数质子数=电子数质子数<电子数模型认知——10电子、18电子粒子(1)常见“10电子”粒子分子离子一核10电子NeN3-、O2-、F-、Na+、Mg2+、Al3+二核10电子HFOH-三核10电子H2ONH四核10电子NH3H3O+五核10电子CH4NH(2)常见“18电子”粒子①分子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4等。②阳离子:K+、Ca2+等。③阴离子:P3-、S2-、HS-、Cl-等。【典例】A+、B+、C-、D、E五种粒子(分子或离子),它们都分别含有10个电子,已知它们有如下转化关系:①A++C-――→D+E↑;②B++C-―→2D。(1)写出①的离子方程式:______________...