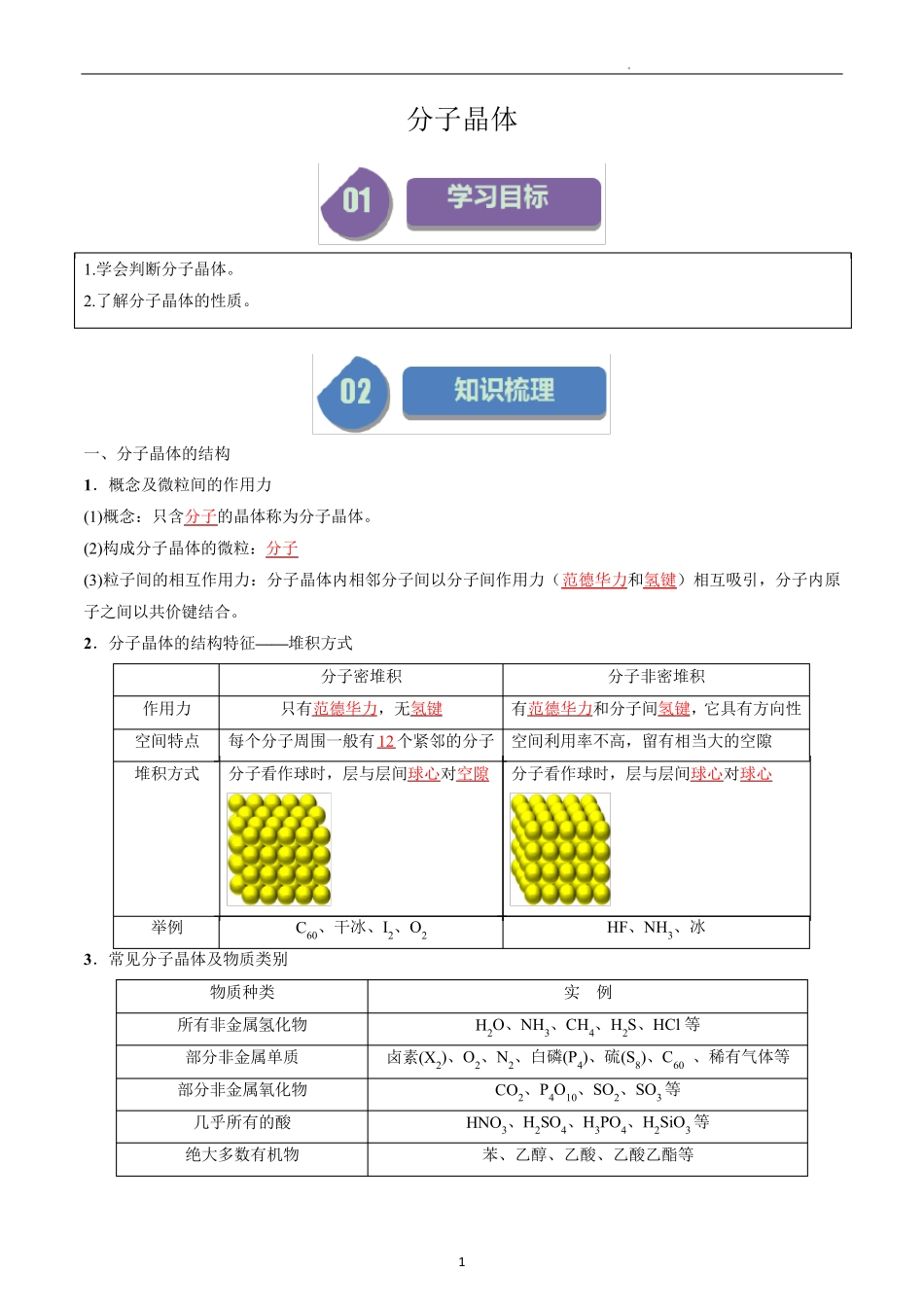
1 分子晶体 1.学会判断分子晶体。 2.了解分子晶体的性质。 一、分子晶体的结构 1.概念及微粒间的作用力 (1)概念:只含分子的晶体称为分子晶体。 (2)构成分子晶体的微粒:分子 (3)粒子间的相互作用力:分子晶体内相邻分子间以分子间作用力(范德华力和氢键)相互吸引,分子内原子之间以共价键结合。 2.分子晶体的结构特征——堆积方式 分子密堆积 分子非密堆积 作用力 只有范德华力,无氢键 有范德华力和分子间氢键,它具有方向性 空间特点 每个分子周围一般有12 个紧邻的分子 空间利用率不高,留有相当大的空隙 堆积方式 分子看作球时,层与层间球心对空隙 分子看作球时,层与层间球心对球心 举例 C60、干冰、I2、O2 HF、NH3、冰 3.常见分子晶体及物质类别 物质种类 实 例 所有非金属氢化物 H2O、NH3、CH4、H2S、HCl 等 部分非金属单质 卤素(X2)、O2、N2、白磷(P4)、硫(S8)、C60 、稀有气体等 部分非金属氧化物 CO2、P4O10、SO2、SO3 等 几乎所有的酸 HNO3、H2SO4、H3PO4、H2SiO3 等 绝大多数有机物 苯、乙醇、乙酸、乙酸乙酯等 2 【特别提醒】金刚石、二氧化硅不是分子晶体。 二、分子晶体的性质 1.分子晶体的物理特性 ①分子晶体具有熔、沸点较低。 ②硬度较小。 ③固态不导电。 2 .分子晶体熔沸点低的原因 分子晶体中粒子间是以范德华力或范德华力和氢键而形成的晶体,因此,分子晶体的熔、沸点较低,密度较小,硬度较小,较易熔化和挥发。所有在常温下呈气态的物质、常温下呈液态的物质(除汞外)、易升华的固体物质都属于分子晶体,熔化时,一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。 3 .分子晶体的熔、沸点比较 ①分子晶体熔化或汽化都是克服分子间作用力。分子间作用力越大,物质熔化或汽化时需要的能量就越多,物质的熔、沸点就越高。 ②比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范德华力和氢键)的大小。 A.组成和结构相似的物质,相对分子质量越大,范德华力越大,熔、沸点越高。如O2>N2,HI>HBr>HCl。 B.相对分子质量相等或相近时,极性分子的范德华力大,熔、沸点高,如CO>N2。 C.能形成氢键的物质,熔、沸点较高。如H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3。 D.烃、卤代烃、醇、醛、羧酸等有机物一般随分子中碳原子数的增加,熔、沸点升高,如C2H6>CH4, C2H5Cl>CH3Cl, CH3COOH>HCOOH。 E.在烷烃的同分异构体中,一般来说,支链数越多...