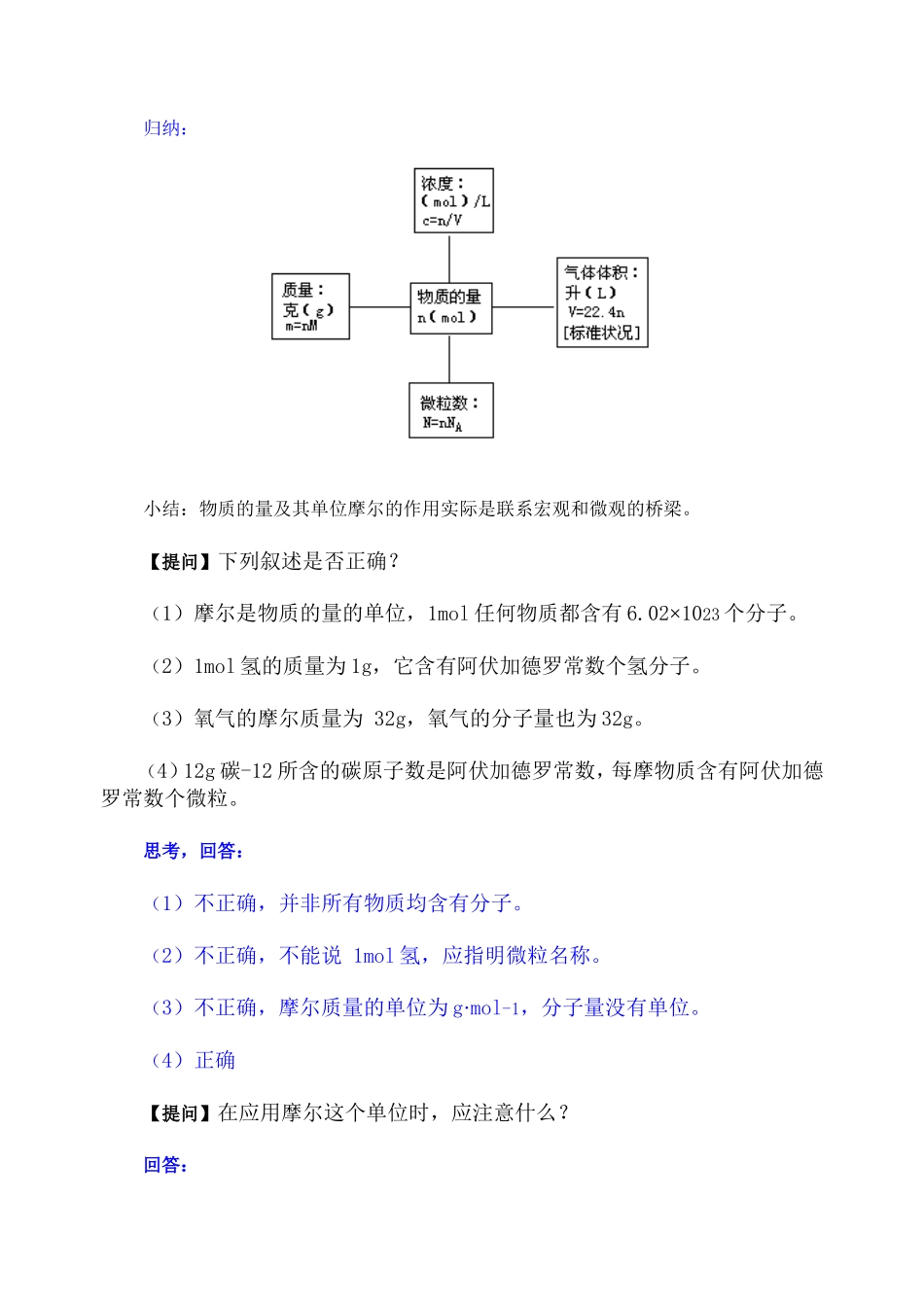
化学常用计量 教学目标知识技能:掌握物质的量及其单位——摩尔、摩尔质量、气体摩尔体积的涵义。掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状态下)之间的相互关系。能力培养:通过基本计算问题的讨论,培养学生的计算思维能力。科学思想:在阿伏加德罗定律的应用上,着重掌握有关比例的数学思想。科学方法:演绎推理法。重点、难点 物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系是重点,气体摩尔体积的应用条件是难点。 教学过程设计 教师活动【引入】今天我们复习化学常用计量。【提问】科学家引入物质的量这个物理量的意义是什么?【再问】谁来说说物质的量是怎样联系宏观和微观的?学生活动回答:把质量、体积等宏观物理量和微观的微粒个数联系起来。回答:主要通过以物质的量为核心物理量建立的下列关系图,把微粒数、物质质量、气体标准状况下的体积、溶液的物质的量浓度等相互关联起来。归纳:小结:物质的量及其单位摩尔的作用实际是联系宏观和微观的桥梁。【提问】下列叙述是否正确?(1)摩尔是物质的量的单位,1mol 任何物质都含有 6.02×1023 个分子。(2)1mol 氢的质量为 1g,它含有阿伏加德罗常数个氢分子。(3)氧气的摩尔质量为 32g,氧气的分子量也为 32g。(4)12g 碳-12 所含的碳原子数是阿伏加德罗常数,每摩物质含有阿伏加德罗常数个微粒。思考,回答:(1)不正确,并非所有物质均含有分子。(2)不正确,不能说 1mol 氢,应指明微粒名称。(3)不正确,摩尔质量的单位为 g·mol-1,分子量没有单位。(4)正确【提问】在应用摩尔这个单位时,应注意什么?回答:(1)摩尔只能用来表示微粒的集体数目;(2)必须指明微粒的具体名称。【讲解】微粒可以是真实的,如:1mol 水分子;也可以是假想的,如:1mol NaCl,表示 1molNa+和 1mol Cl- 的特定组合。【提问】在化学反应中,下列叙述正确的是:A.反应物的物质的量之和一定等于各生成物的物质的量之和B.反应前原子的物质的量之和一定等于反应后原子的物质的量之和C.反应前各物质的摩尔质量之和一定等于反应后生成物的摩尔质量之和D.在同温、同压下,反应前气体体积之和一定等于反应后气体体积之和思考,回答:A.不正确,因为化学反应前后,分子数是可能发生变化的。B.正确,因为原子是化学变化中的最小微粒。C.不正确,因为分子是变化的,分子量很可能变化,摩尔质量也随之变化。D....