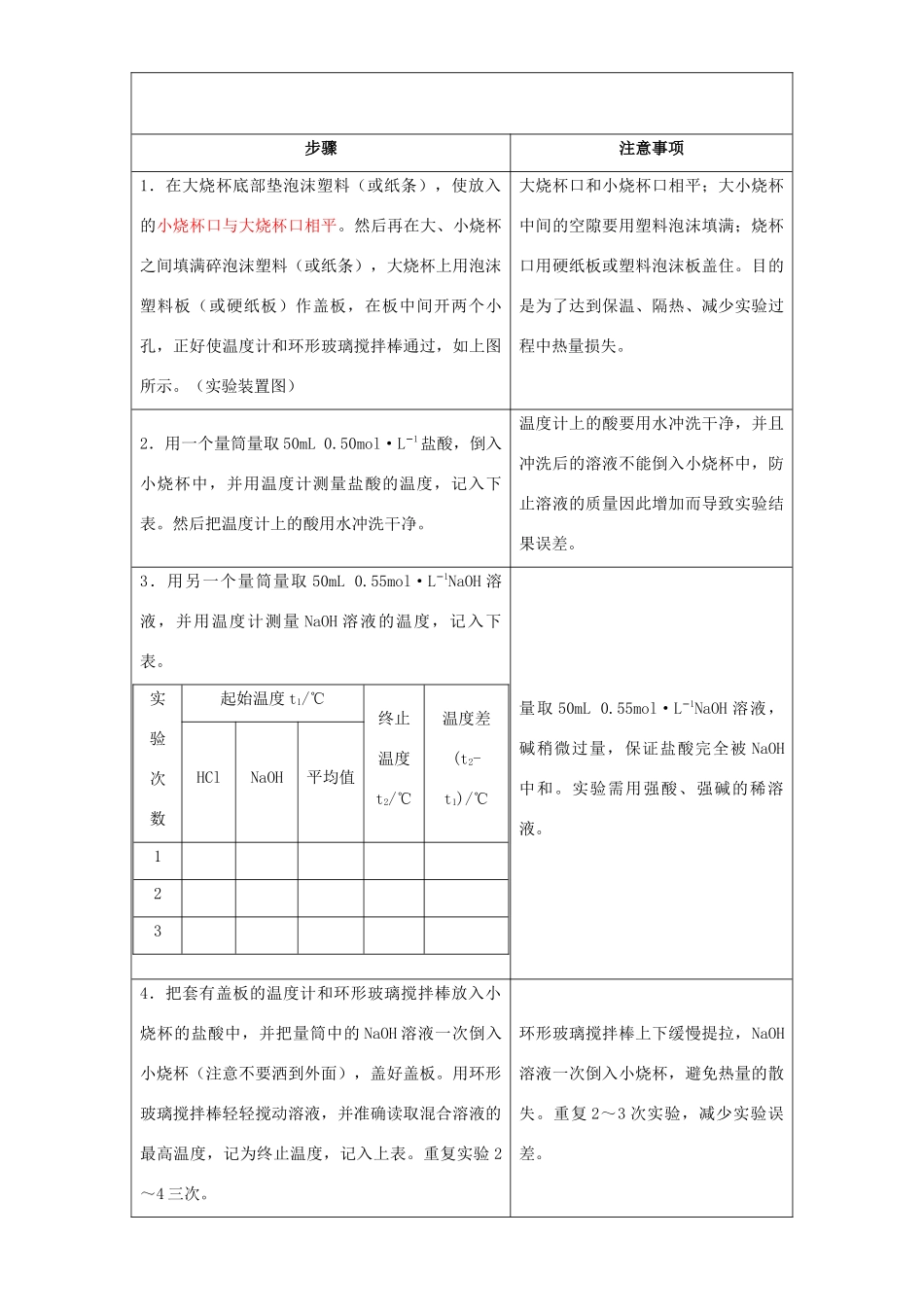
中和反应反应热的测定中和反应反应热的测定1、测定强酸与强碱反应的反应热2、掌握强酸和强碱反应的中和热测定的误差分析3、加深对酸碱中和反应是放热反应的理解在稀溶液中,强酸和强碱发生中和反应生成1mol水时的反应热叫中和热H+(aq)+OH−(aq)=H2O(l);△H=-57.3kJ·mol1−(文献值)计算方法:(强酸和强碱反应)Q=mCΔt其中Q:中和反应放出的热量。m:反应混合液的质量。C:反应混合液的比热容。△t:反应前后溶液温度差中和热计算公式:△H=-=-=-大烧杯(500ml)、小烧杯(100ml)、温度计、量筒两个、泡沫塑料或纸条、泡沫塑料板或硬纸板、环形玻璃搅拌棒0.50mol·L1−盐酸、0.55mol·L1−NaOH溶液2HOQn21221()()HOmmcttn2+HOn21酸酸碱碱(VV)c(t-t)步骤注意事项1.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯口与大烧杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如上图所示。(实验装置图)大烧杯口和小烧杯口相平;大小烧杯中间的空隙要用塑料泡沫填满;烧杯口用硬纸板或塑料泡沫板盖住。目的是为了达到保温、隔热、减少实验过程中热量损失。2.用一个量筒量取50mL0.50mol·L1−盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。温度计上的酸要用水冲洗干净,并且冲洗后的溶液不能倒入小烧杯中,防止溶液的质量因此增加而导致实验结果误差。3.用另一个量筒量取50mL0.55mol·L1−NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。实验次数起始温度t1/℃终止温度t2/℃温度差(t2-t1)/℃HClNaOH平均值123量取50mL0.55mol·L1−NaOH溶液,碱稍微过量,保证盐酸完全被NaOH中和。实验需用强酸、强碱的稀溶液。4.把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入上表。重复实验2~4三次。环形玻璃搅拌棒上下缓慢提拉,NaOH溶液一次倒入小烧杯,避免热量的散失。重复2~3次实验,减少实验误差。5.取测量所得数据的平均值作为计算依据,根据实验数据计算中和热。误差较大的一组数据舍弃不用1.取三次测量所得数据的平均值作为计算依据t1/℃t2/℃(t2-t1)/℃2.计算反应热为了计算简便,我们近似的认为实验所用酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容;V酸=V碱=50ml;盐酸的质量m1=50g,NaOH溶液的质量m2=50g;中和后生成的溶液的比热容c=4.18J/(g·℃)50mL0.50mol·L1−盐酸和50mL0.55mol·L1−NaOH溶液发生中和反应时放出的热量为:Q=(m1+m2)·c·(t2℃-t1℃)=100g×4.18J/(g·℃)(t2-t1)℃=0.418(t2-t1)KJ生成的水的物质的量:n=0.050L×0.50mol·L1−=0.025mol生成1molH2O时的中和热为:△H=-=-1.温度计上的酸为何要用水冲洗干净?冲洗后的溶液能否倒入小烧杯?为什么?因为该温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失,故要冲洗干净。冲洗后的溶液不能倒入小烧杯,若倒入,会使总溶液的质量增加,而导致实验结果误差。2.实验中所用HCl和NaOH的物质的量比为何不是1∶1而是NaOH过量?若用HCl过量行吗?为了保证0.50mol·L1−的盐酸完全被NaOH中和,采用0.55mol·L1−NaOH溶液,使碱稍稍过量。若使盐酸过量,亦可。3.本实验中若把50mL0.50mol·L1−的盐酸改为50mL会有所变化。因为醋酸为弱电解质,其电离时要吸热,故将使测得中和热偏大。2HOQn210.418()0.025ttKJmol误差分析0.50mol·L1−醋酸,所测结果是否会有所变化?为什么?或将稀盐酸换成浓硫酸,又是怎样的变化?浓硫酸在稀释的过程中会放出大量的热,会使得结果偏低。4.若改用100mL0.50mol·L1−的盐酸和100mL0.55mol·L1−的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?否。因所测中和热是指强酸与强碱发生中和反应生成1molH2O时放出...