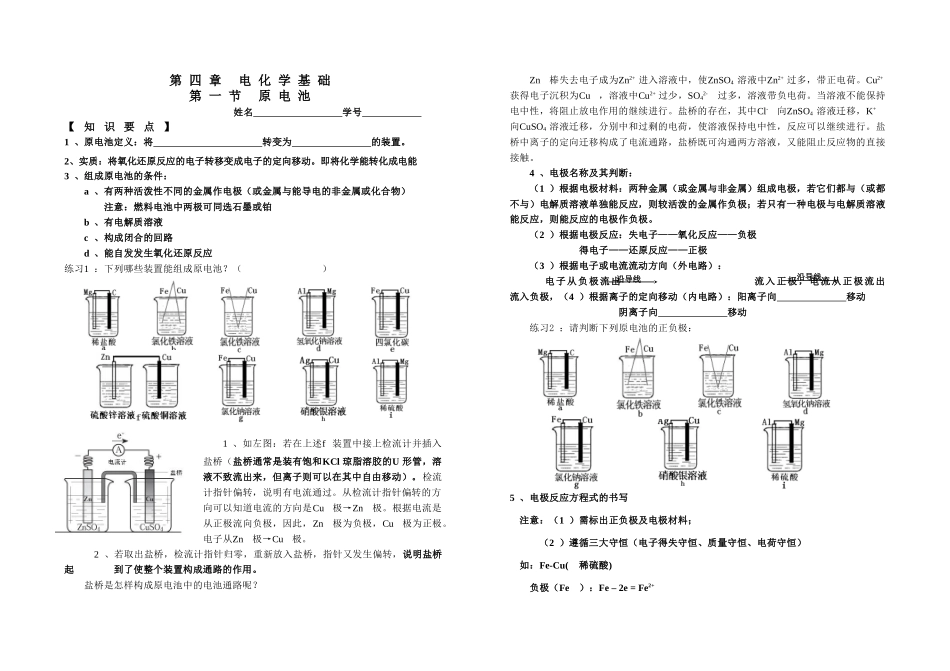
第 四 章 电 化 学 基 础 第 一 节 原 电 池 姓名 学号 【 知 识 要 点 】1 、原电池定义:将 转变为 的装置。2、实质:将氧化还原反应的电子转移变成电子的定向移动。即将化学能转化成电能3 、组成原电池的条件:a 、有两种活泼性不同的金属作电极(或金属与能导电的非金属或化合物)注意:燃料电池中两极可同选石墨或铂b 、有电解质溶液c 、构成闭合的回路d 、能自发发生氧化还原反应练习1 :下列哪些装置能组成原电池?( )1 、如左图:若在上述f 装置中接上检流计并插入盐桥(盐桥通常是装有饱和KCl 琼脂溶胶的U 形管,溶液不致流出来,但离子则可以在其中自由移动)。检流计指针偏转,说明有电流通过。从检流计指针偏转的方向可以知道电流的方向是Cu极→Zn极。根据电流是从正极流向负极,因此,Zn极为负极,Cu极为正极。电子从Zn极→Cu极。 2 、若取出盐桥,检流计指针归零,重新放入盐桥,指针又发生偏转,说明盐桥起 到了使整个装置构成通路的作用。盐桥是怎样构成原电池中的电池通路呢?Zn棒失去电子成为Zn2+ 进入溶液中,使ZnSO4 溶液中Zn2+ 过多,带正电荷。Cu2+获得电子沉积为Cu,溶液中Cu2+ 过少,SO42-过多,溶液带负电荷。当溶液不能保持电中性,将阻止放电作用的继续进行。盐桥的存在,其中Cl-向ZnSO4 溶液迁移,K+向CuSO4 溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触。4 、电极名称及其判断:(1 )根据电极材料:两种金属(或金属与非金属)组成电极,若它们都与(或都不与)电解质溶液单独能反应,则较活泼的金属作负极;若只有一种电极与电解质溶液能反应,则能反应的电极作负极。 (2 )根据电极反应:失电子——氧化反应——负极 得电子——还原反应——正极(3 )根据电子或电流流动方向(外电路): 电子从负极流出 流入正极,电流从正极流出 流入负极,(4 )根据离子的定向移动(内电路):阳离子向 移动 阴离子向 移动练习2 :请判断下列原电池的正负极:5 、电极反应方程式的书写注意:(1 )需标出正负极及电极材料;(2 )遵循三大守恒(电子得失守恒、质量守恒、电荷守恒)如:Fe-Cu( 稀硫酸) 负极(Fe):Fe – 2e = Fe2+沿导线沿导线放电充电正极(Cu ):2H+ +2e = H2↑总反应:Fe + 2H+ = Fe2+ + H2↑练习3 :请...