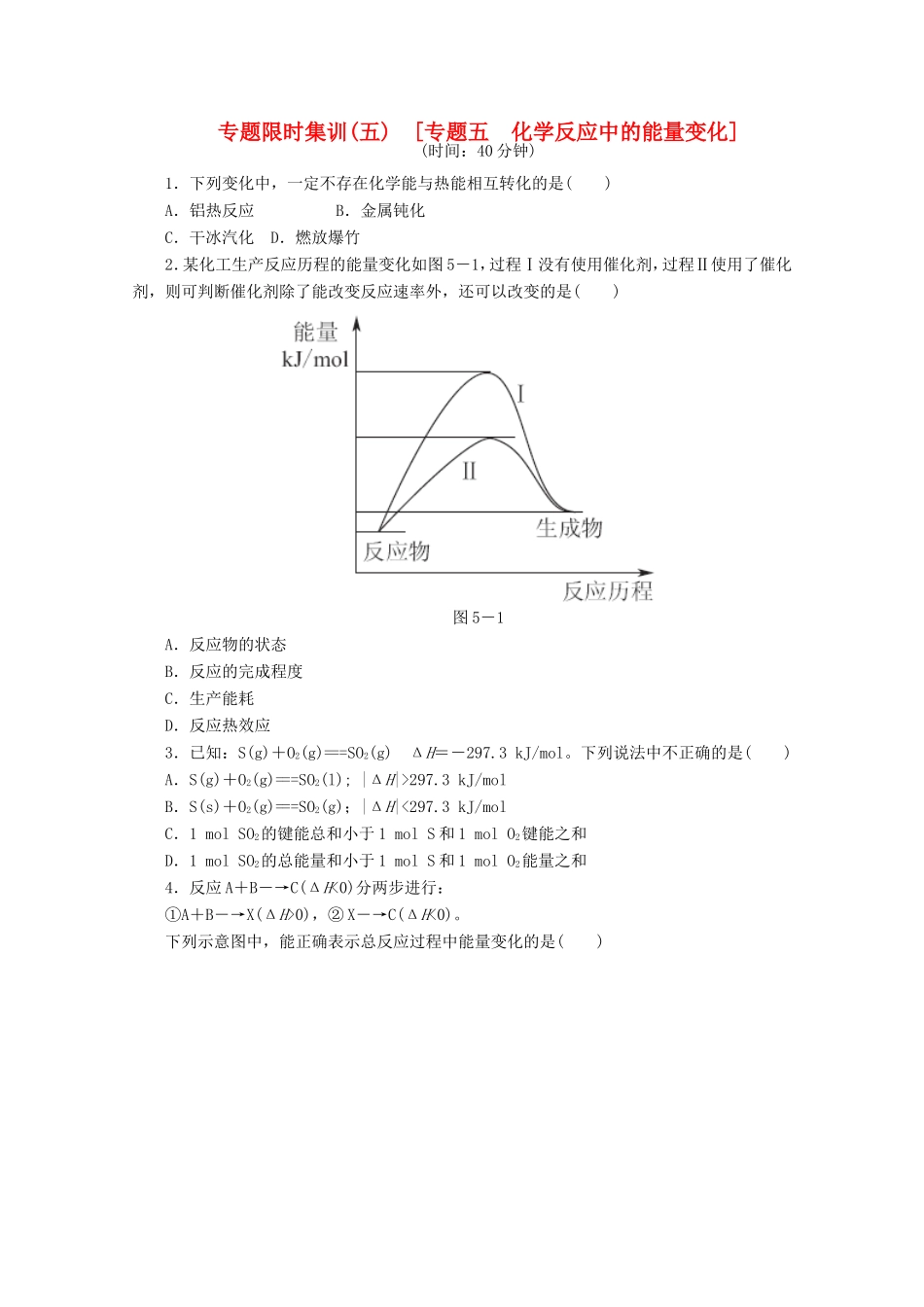
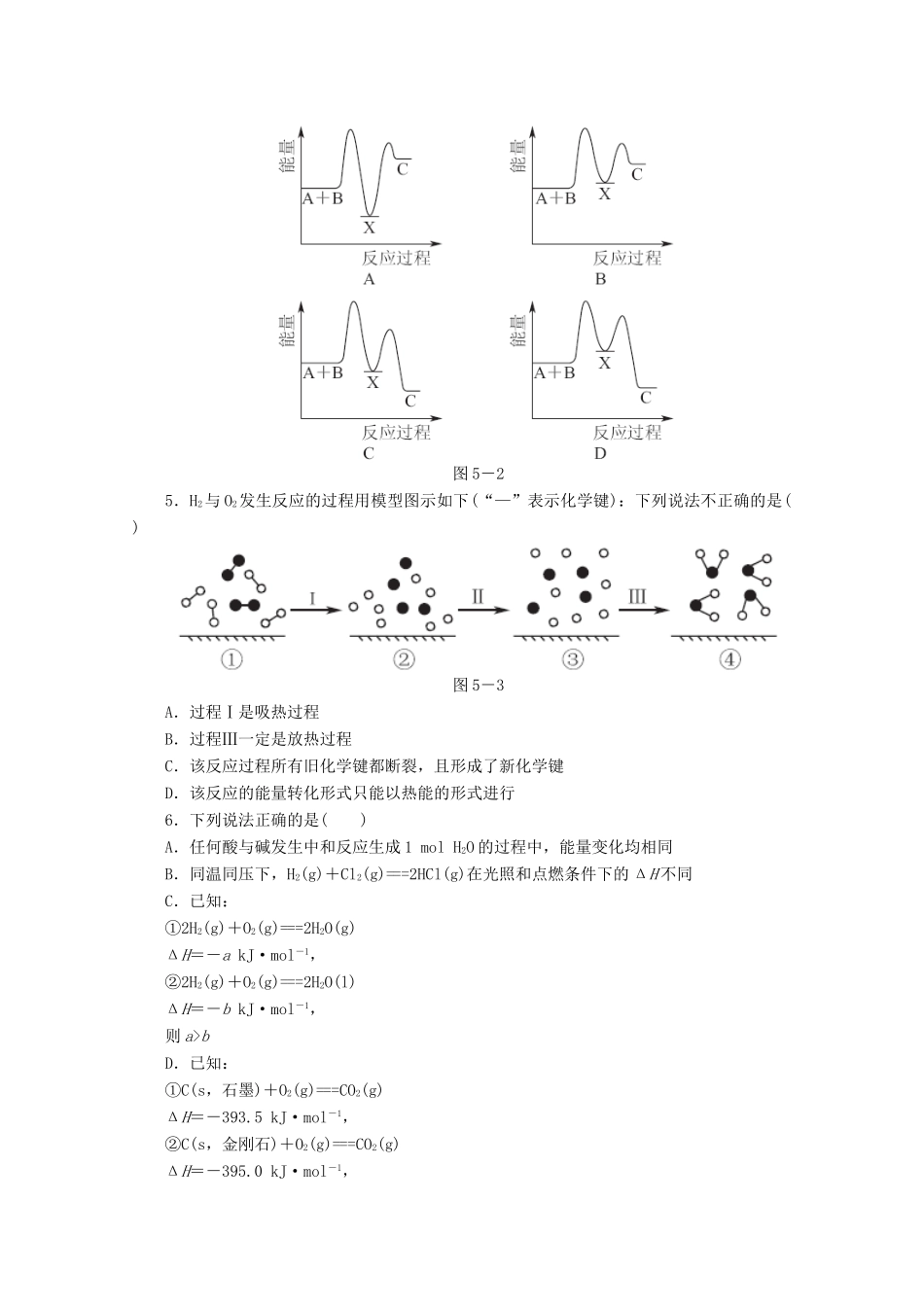
专题限时集训(五)[专题五化学反应中的能量变化](时间:40分钟)1.下列变化中,一定不存在化学能与热能相互转化的是()A.铝热反应B.金属钝化C.干冰汽化D.燃放爆竹2.某化工生产反应历程的能量变化如图5-1,过程Ⅰ没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是()图5-1A.反应物的状态B.反应的完成程度C.生产能耗D.反应热效应3.已知:S(g)+O2(g)===SO2(g)ΔH=-297.3kJ/mol。下列说法中不正确的是()A.S(g)+O2(g)===SO2(l);|ΔH|>297.3kJ/molB.S(s)+O2(g)===SO2(g);|ΔH|<297.3kJ/molC.1molSO2的键能总和小于1molS和1molO2键能之和D.1molSO2的总能量和小于1molS和1molO2能量之和4.反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是()图5-25.H2与O2发生反应的过程用模型图示如下(“—”表示化学键):下列说法不正确的是()图5-3A.过程Ⅰ是吸热过程B.过程Ⅲ一定是放热过程C.该反应过程所有旧化学键都断裂,且形成了新化学键D.该反应的能量转化形式只能以热能的形式进行6.下列说法正确的是()A.任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同C.已知:①2H2(g)+O2(g)===2H2O(g)ΔH=-akJ·mol-1,②2H2(g)+O2(g)===2H2O(l)ΔH=-bkJ·mol-1,则a>bD.已知:①C(s,石墨)+O2(g)===CO2(g)ΔH=-393.5kJ·mol-1,②C(s,金刚石)+O2(g)===CO2(g)ΔH=-395.0kJ·mol-1,则C(s,石墨)=C(s,金刚石)ΔH=+1.5kJ·mol-17.下列说法正确的是()A.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据B.25℃、101kPa时,1molS和2molS的燃烧热不相等C.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能化学键H—HCl—ClH—Cl生成1mol化学键时放出的能量436kJ/mol243kJ/mol431kJ/mol则H2(g)+Cl2(g)===HCl(g)ΔH=-183kJ/molD.任何化学反应都伴随着能量的变化8.下列与化学反应能量变化相关的叙述正确的是()A.生成物能量一定低于反应物能量B.放热反应的反应速率总是大于吸热反应的反应速率C.应用盖斯定律,可以计算某些难以直接测量的反应的焓变D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同9.(双选)下列说法或表示方法正确的是()A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多B.由H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3kJ/mol可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJC.由C(石墨)===C(金刚石)ΔH=+1.90kJ/mol可知,金刚石比石墨稳定D.已知在298K时下述反应的有关数据:C(s)+O2(g)===CO(g),ΔH1=-110.5kJ/mol;C(s)+O2(g)===CO2(g),ΔH2=-393.5kJ/mol,则C(s)+CO2(g)===2CO(g)的ΔH=+172.5kJ/mol10.(双选)在298K、100kPa时,已知:2H2O(g)===O2(g)+2H2(g)ΔH1;Cl2(g)+H2(g)===2HCl(g)ΔH2;2Cl2(g)+2H2O(g)===4HCl(g)+O2(g)ΔH3。则ΔH3与ΔH1和ΔH2间的关系正确的是()A.ΔH3=ΔH1+2ΔH2B.ΔH3=ΔH1+ΔH2C.=ΔH2D.ΔH3=ΔH1-ΔH211.合成氨工业的核心反应是:N2(g)+3H2(g)2NH3(g)ΔH=QkJ·mol-1上述反应在无催化作用时的能量变化如图5-4所示。图5-4请回答下列问题:(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。(2)在500℃、50MPa和催化剂条件下向一密闭容器中充入0.5molN2和1.5molH2,充分反应后,放出的热量________(填“<”、“>”或“=”)46.2kJ,理由是________________________________________________________________________________________________________________________________________________________________________________________________________________________。(3)500℃、50MPa时,在容积为VL的恒容密闭容器中加入nmolN2、3nmolH2,反应达平衡后测得平衡常数为K1,此...