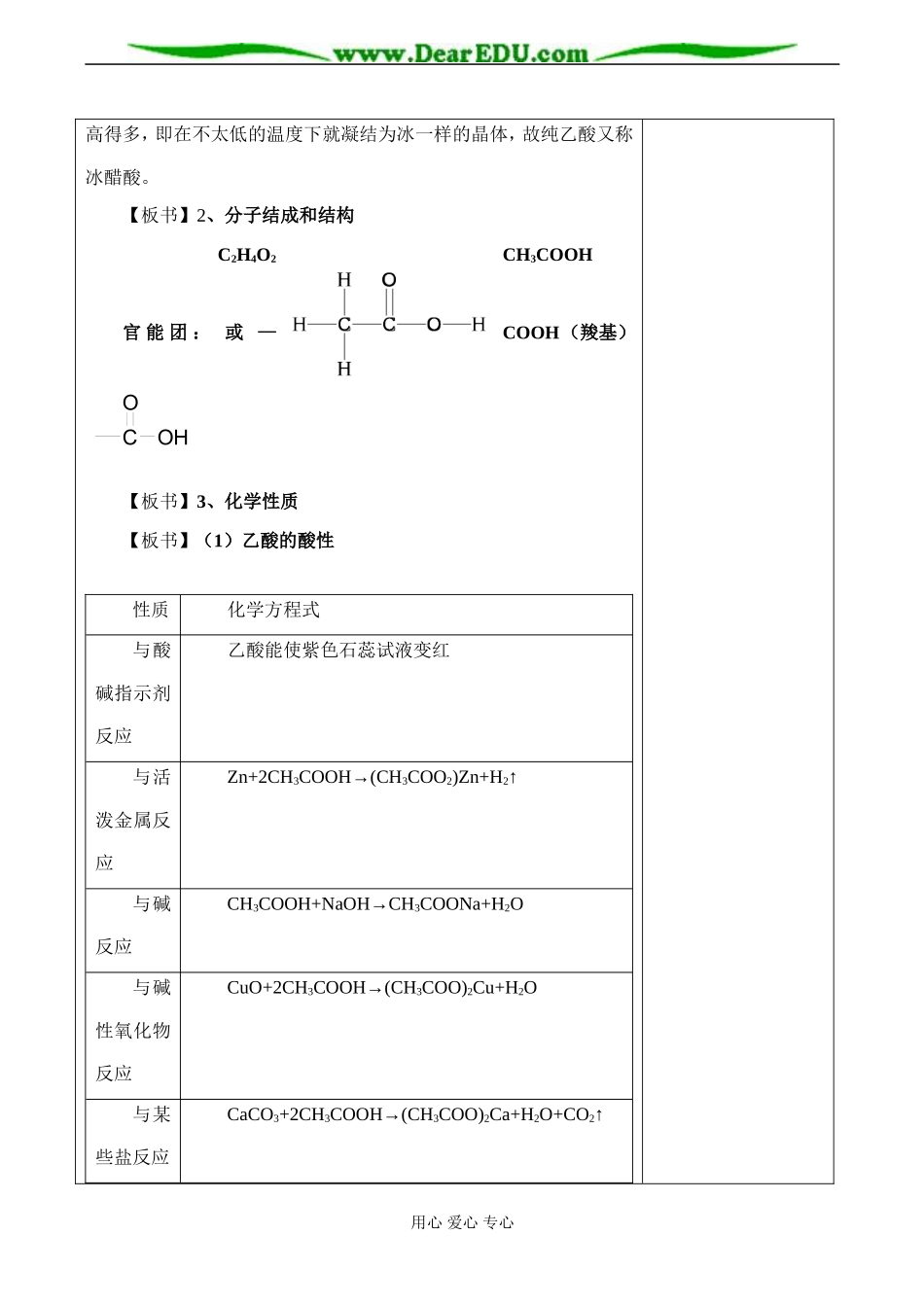
课题羧酸酯(第一课时)课程目标知识与技能1、了解羧酸的结构特点,熟悉乙酸的弱酸性和酯化反应。2、了解酯的结构特点,理解酯水解的原理。过程与方法通过实验来学习乙酸的性质,熟悉酯化反应的操作。情感态度与价值观学习本节内容,可以培养学生正确理解生活中的某些现象,树立正确的科学观。教学重点羧酸的酯化反应原理和酯水解的原理教学难点酯水解反应的基本规律教学过程二次备课一、情境导入为何在醋中加少量白酒,醋的味道就会变得芳香而且不易变质?厨师烧鱼时常加醋并加点酒,为何这样鱼味道就变得无腥、香醇,特别鲜美?通过本节课的学习,大家便会知道其中的奥妙。二、授新课第二节羧酸酯师:乙酸又叫醋酸,因为食醋中会有3-5%的乙酸。通过对醋的了解,我们能感受到乙酸的哪些物理性质?【回答】有刺激性气味-能挥发;有酸味;易溶于水;黑色或白色等等。师:醋的颜色是否就是醋酸本身的颜色?纯乙酸究竟是什么颜色的?看书总结乙酸的物理性质。【板书】一、羧酸1、物理性质色味态mp.bp.溶解(无刺激性液6.6℃117.9℃易溶于水和乙醇)【强调】我们能闻到乙酸的气味,说明乙酸能挥发,但是乙酸的沸点比水的沸点高,故不易挥发。同时其熔点为16.6℃,比水的凝固点用心爱心专心高得多,即在不太低的温度下就凝结为冰一样的晶体,故纯乙酸又称冰醋酸。【板书】2、分子结成和结构C2H4O2CH3COOH官能团:或—COOH(羧基)COOH【板书】3、化学性质【板书】(1)乙酸的酸性性质化学方程式与酸碱指示剂反应乙酸能使紫色石蕊试液变红与活泼金属反应Zn+2CH3COOH→(CH3COO2)Zn+H2↑与碱反应CH3COOH+NaOH→CH3COONa+H2O与碱性氧化物反应CuO+2CH3COOH→(CH3COO)2Cu+H2O与某些盐反应CaCO3+2CH3COOH→(CH3COO)2Ca+H2O+CO2↑用心爱心专心酸性由强到弱顺序:HCl>H2SO3>CH3COOH>H2CO3>【过渡】乙酸除具有酸的通性外,还可以发生酯化反应【板书】2、酯化反应师:在高一的时候已经对乙酸的酯化反应进行了学习,并做了酯化反应的实验,大家回忆一下此实验需要的试剂、反应原理、装置以及注意点。(1)乙醇,浓硫酸和冰醋酸。(2)先加入乙醇,再缓慢加入浓硫酸和冰醋酸,边加边振荡。(3)饱和碳酸钠溶液上层有无色油状液体,并有香味。【讲述】饱和碳酸钠溶液上层有香味的无色油状液体生成,我们知道就是乙酸乙酯。【板书】CH3COOH+HOC2H5CH3COOC2H5+H2O乙酸乙酯酸和醇起反应生成酯和水的反应,叫做酯化反应。【设疑】在上述反应中,生成水的氧原子由乙酸的羟基提供,还是由乙醇的羟基提供?用什么方法可以证明呢?【板书】酯化反应实质——一般羧酸脱去羟基,醇脱去羟基上的氢原子。【说明】这是教材中第一次用实验来研究反应历程。反应历程不是根据化学方程式来推断的,是以实验事实为依据的。一同位素示踪原子来进行实验,也是一种先进的实验方法,不仅揭示反应实质,还可以推进科学的发展。用心爱心专心浓硫酸【思考】(1)浓硫酸有何作用?(催化剂,脱水剂)(2)加热的目的是什么?(主要目的是提高反应速率,其次是使生成的乙酸乙酯挥发而收集,提高乙醇乙酸的转化率)(3)在该反应中,为什么要强调加冰醋酸和无水乙醇,而不用他们的水溶液?(因为冰醋酸与无水乙醇基本不含水,可以促使化学平衡向生成酯的方向移动)(4)为何要用饱和碳酸钠溶液作吸收剂而不直接用水?(由于乙醇的沸点(78.9℃)和乙酸的沸点(117.9℃)都较低,当乙酸乙酯形成蒸气被导出时,其中会混有少量乙醇和乙酸的蒸气。冷却后的乙酸乙酯跟乙酸、乙醇混溶在一起而难于分离。向刚收集到的酯中滴紫色石蕊试液,观察到呈紫红色;加饱和碳酸钠溶液后,振荡,有大量气泡产生,红色褪去,都能证明了酯中混有乙酸。)【板书】饱和碳酸钠溶液的作用:a.便于分离:酯在饱和碳酸钠溶液中的溶解度更小,有利于酯的分层。b.便于提纯:饱和碳酸钠溶液能溶解乙醇,吸收乙酸。【小结】本节课的重点是掌握乙酸的分子结构和化学性质,特别是酯化反应的实质——一般羧酸脱去羟基,醇脱去羟基上的氢原子。三、当堂反馈四、课堂小结附:板书设计用心爱心专心教学后记:主备人:用心爱心专心