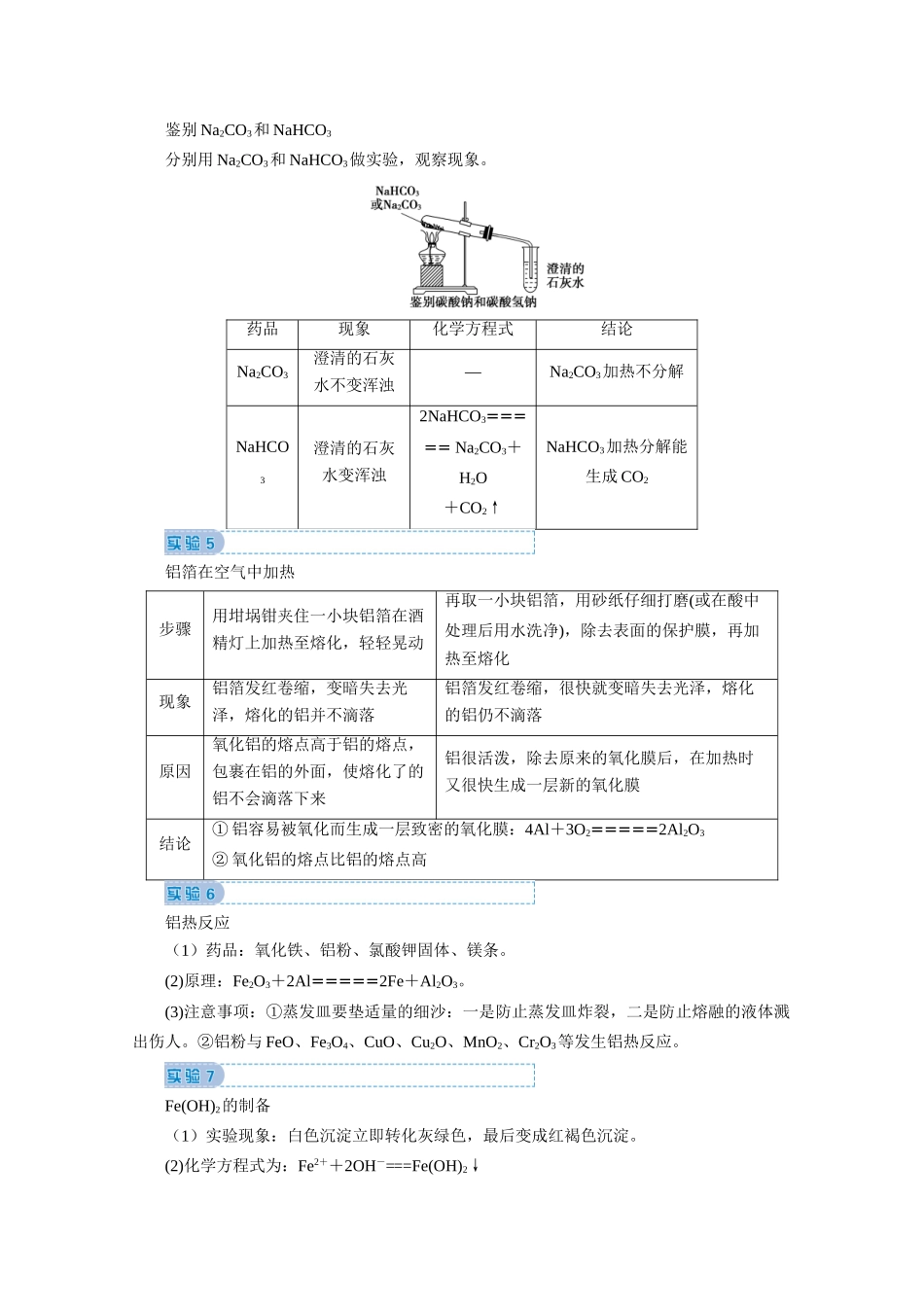
秘笈二回归教材实验配制一定物质的量浓度的溶液(1)主要仪器(2)注意事项①容量瓶:只有一个刻度线,只能配制瓶上规定容积的溶液,若配制480mL溶液应用500mL容量瓶。②写所用仪器时,容量瓶必须注明规格。③容量瓶使用之前必须查漏。(3)误差分析依据:cB==焰色反应(1)步骤:洗—烧—蘸—烧—洗—烧。(2)用品:铂丝或光洁无锈的铁丝、稀盐酸、样品。(3)注意事项:焰色反应是物理变化;Na,K的焰色:黄色、紫色(透过蓝色的钴玻璃)。钠和过氧化钠(1)取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的外皮。现象:在钠新切口处可以观察到银白色的金属光泽,切口处在空气中很快变暗(氧化成Na2O)。(2)把一小块金属钠放在坩埚里加热。现象:钠先熔化成小球,然后燃烧,发出黄色火焰,生成淡黄色的固体(生成Na2O2)。(3)向盛有水的小烧杯中滴入几滴酚酞溶液,把一小块钠放入水中。现象:钠浮在水面上(密度比水小),熔成小球(反应放热、钠的熔点低),小球四处游动,并有嘶嘶的响声(有气体产生),溶液变为红色(生成碱性物质)。(4)把水滴入盛有少量Na2O2固体的试管中,立即把带火星的木条放在试管口,检验生成的气体,该反应放出大量的热,同时产生O2。鉴别Na2CO3和NaHCO3分别用Na2CO3和NaHCO3做实验,观察现象。药品现象化学方程式结论Na2CO3澄清的石灰水不变浑浊—Na2CO3加热不分解NaHCO3澄清的石灰水变浑浊2NaHCO3=====Na2CO3+H2O+CO2↑NaHCO3加热分解能生成CO2铝箔在空气中加热步骤用坩埚钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动再取一小块铝箔,用砂纸仔细打磨(或在酸中处理后用水洗净),除去表面的保护膜,再加热至熔化现象铝箔发红卷缩,变暗失去光泽,熔化的铝并不滴落铝箔发红卷缩,很快就变暗失去光泽,熔化的铝仍不滴落原因氧化铝的熔点高于铝的熔点,包裹在铝的外面,使熔化了的铝不会滴落下来铝很活泼,除去原来的氧化膜后,在加热时又很快生成一层新的氧化膜结论①铝容易被氧化而生成一层致密的氧化膜:4Al+3O2=====2Al2O3②氧化铝的熔点比铝的熔点高铝热反应(1)药品:氧化铁、铝粉、氯酸钾固体、镁条。(2)原理:Fe2O3+2Al=====2Fe+Al2O3。(3)注意事项:①蒸发皿要垫适量的细沙:一是防止蒸发皿炸裂,二是防止熔融的液体溅出伤人。②铝粉与FeO、Fe3O4、CuO、Cu2O、MnO2、Cr2O3等发生铝热反应。Fe(OH)2的制备(1)实验现象:白色沉淀立即转化灰绿色,最后变成红褐色沉淀。(2)化学方程式为:Fe2++2OH-===Fe(OH)2↓4Fe(OH)2+O2+2H2O===4Fe(OH)3。(3)注意事项:Fe(OH)2具有较强的还原性容易被氧化①所用亚铁盐溶液必须是新制的,NaOH溶液必须煮沸;②胶头滴管须插入试管底部;③往往在液面加一层油膜,如少量煤油、苯或植物油等;或用改进装置如图所示。氯气的实验室制法(1)氯气的实验室制法原理:MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O。(2)装置分析先通过饱和食盐水除去氯气中的氯化氢,再通过浓硫酸除去水蒸气,然后用向上排空气法收集氯气,最后用NaOH溶液吸收尾气,以防污染环境。氨气的实验室制法(1)反应原理:2NH4Cl+Ca(OH)2=====CaCl2+2NH3↑+2H2O。(2)气体制备流程:原理—发生装置—除杂干燥—收集—验满—尾气处理。(3)注意事项:①制备装置中试管口要略低于试管底,收集装置中导管应插入试管底部。②浓氨水(或浓铵盐溶液)溶液滴到生石灰或烧碱中制氨气,或浓氨水直接加热也可制氨气。③不能使用NH4Cl和NH4HCO3制备。喷泉实验(1)实验原理:①氨气极易溶于水;②利用压强变化。(2)注意事项:①氨气应充满;②烧瓶应干燥;③装置不得漏气。(3)实验拓展:①NH3、HCl、HBr、HI、SO2等气体均能溶于水形成喷泉。②CO2、H2S、Cl2等与水不能形成喷泉,但与NaOH溶液可形成喷泉。铜与浓硫酸反应的实验(1)实验原理:Cu+2H2SO4(浓)=====CuSO4+SO2↑+2H2O(2)现象:加热之后,试管中的紫色石蕊试液变红(或试管中的品红溶液褪色);将反应后的溶液倒入盛有水的烧杯中,溶液由黑色变成蓝色。(3)原因解释:变黑的物质为被浓硫酸氧化生成CuO,CuO与稀释的硫酸反应生成了CuSO4溶液。中和热实验(1)原理:稀的酸与碱发生中和反应生成1mol液态水...