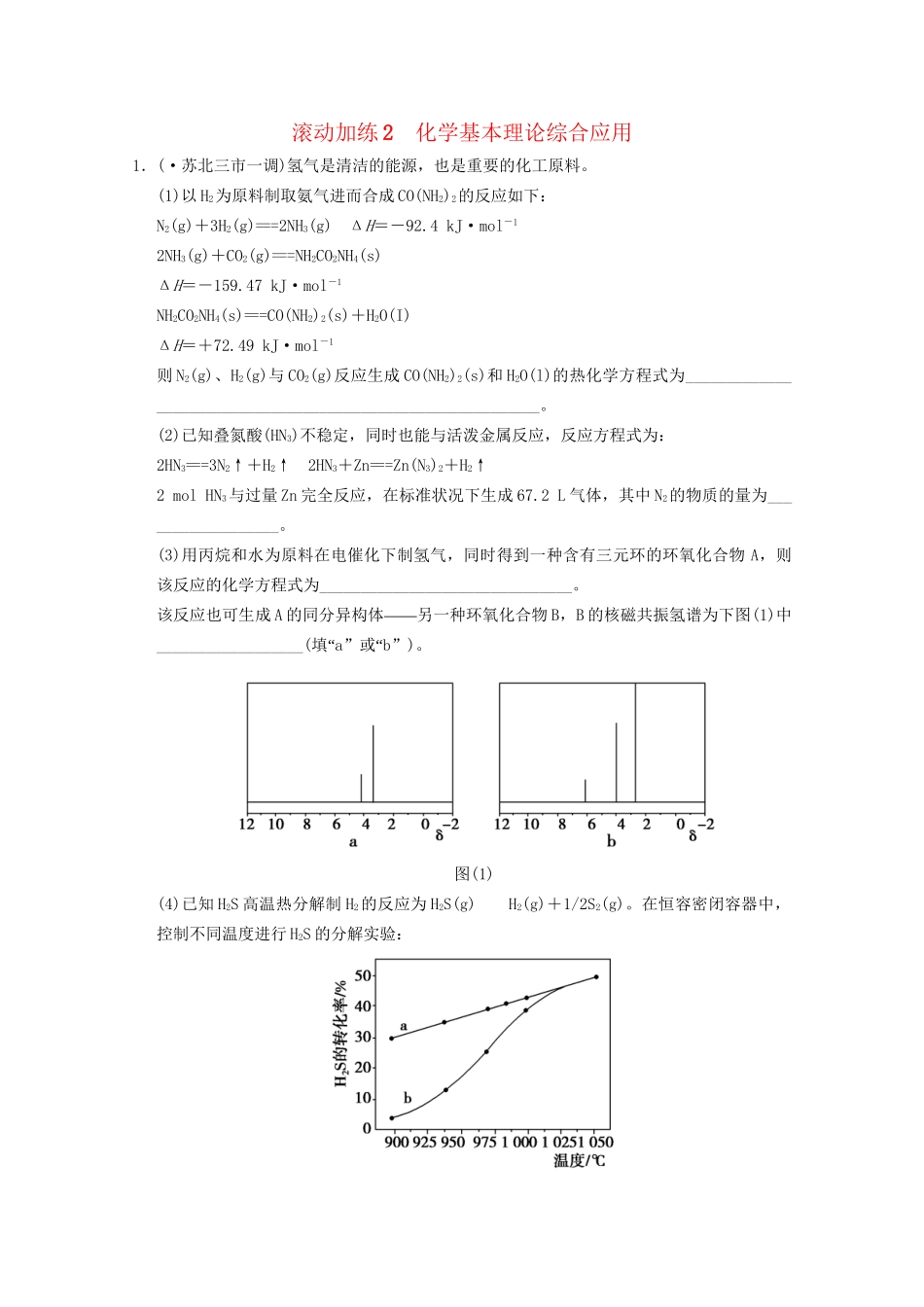
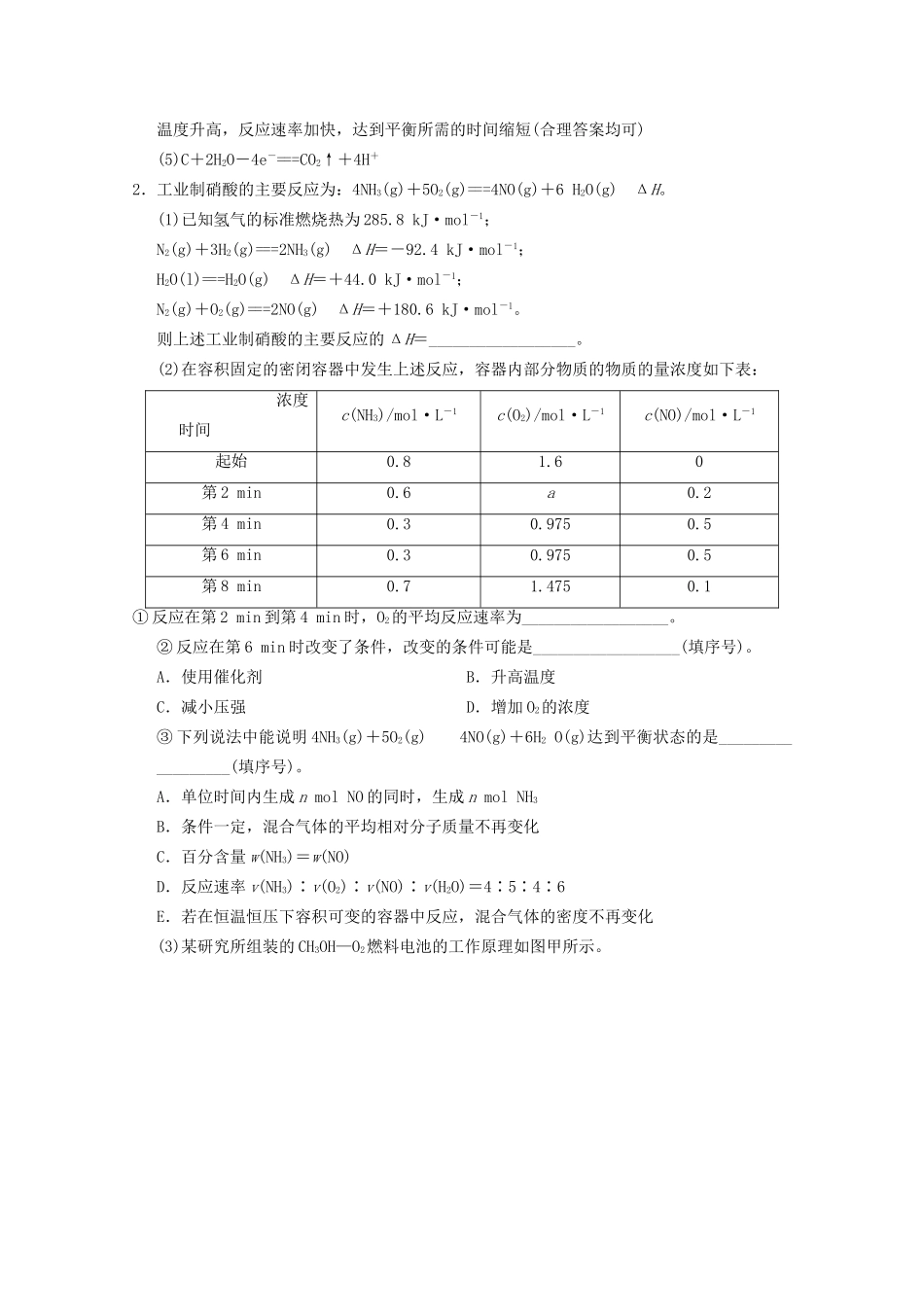
滚动加练2化学基本理论综合应用1.(·苏北三市一调)氢气是清洁的能源,也是重要的化工原料。(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:N2(g)+3H2(g)===2NH3(g)ΔH=-92.4kJ·mol-12NH3(g)+CO2(g)===NH2CO2NH4(s)ΔH=-159.47kJ·mol-1NH2CO2NH4(s)===CO(NH2)2(s)+H2O(I)ΔH=+72.49kJ·mol-1则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为____________________________________________________________。(2)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:2HN3===3N2↑+H2↑2HN3+Zn===Zn(N3)2+H2↑2molHN3与过量Zn完全反应,在标准状况下生成67.2L气体,其中N2的物质的量为__________________。(3)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,则该反应的化学方程式为_______________________________。该反应也可生成A——的同分异构体另一种环氧化合物B,B的核磁共振氢谱为下图(1)中__________________(“填a”“或b”)。图(1)(4)已知H2S高温热分解制H2的反应为H2S(g)H2(g)+1/2S2(g)。在恒容密闭容器中,控制不同温度进行H2S的分解实验:图(2)以H2S的起始浓度均为cmol·L-1测定H2S的转化率,结果如上图(2)所示。图中a曲线为H2S的平衡转化率与温度的关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则反应速率v(H2)=__________________(用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因:_______________________________________。(5)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l)===CO2(g)+2H2(g)现将一定量的1mol·L-1H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02~0.12g·mL-1的煤浆液,置于下图(3)所示装置中进行电解(两电极均为惰性电极)。则A极的电极反应式为___________________________。图(3)解析(1)三式相加,得到N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l)ΔH=-179.38kJ·mol-1。(2)2HN3===3N2↑+H2↑xmol1.5xmol0.5xmol2HN3+Zn===Zn(N3)2+H2↑ymol0.5ymol解得x=4/3y=2/3n(N2)=1.5x=2mol(3)三元环的环氧化合物A是CH3CHOCH2,方程式略,A的同分异物体,而别一种环氧化合物B为CH2CH2CH2O,其核磁共振氢谱为a。(4)v(H2)=v(H2S)=cmol·L-1×40%÷tmin=0.4c/tmol·L-1·min-1。(5)A极为阳极,发生氧化反应C(s)→CO2,介质呈酸性,电极反应式是C+2H2O-4e-===CO2↑+4H+。答案(1)N2(g)+3H2+CO2(g)===CO(NH2)2(s)+H2O(l)ΔH=-179.38kJ·mol-1(2)2mol(3)CH3CH2CH3+H2O―→CH3CHOCH2+2H2(反应条件可写也可不写)a(4)0.4c/tmol·L-1·min-1温度升高,反应速率加快,达到平衡所需的时间缩短(合理答案均可)(5)C+2H2O-4e-===CO2↑+4H+2.工业制硝酸的主要反应为:4NH3(g)+5O2(g)===4NO(g)+6H2O(g)ΔH。(1)已知氢气的标准燃烧热为285.8kJ·mol-1;N2(g)+3H2(g)===2NH3(g)ΔH=-92.4kJ·mol-1;H2O(l)===H2O(g)ΔH=+44.0kJ·mol-1;N2(g)+O2(g)===2NO(g)ΔH=+180.6kJ·mol-1。则上述工业制硝酸的主要反应的ΔH=__________________。(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:浓度时间c(NH3)/mol·L-1c(O2)/mol·L-1c(NO)/mol·L-1起始0.81.60第2min0.6a0.2第4min0.30.9750.5第6min0.30.9750.5第8min0.71.4750.1①反应在第2min到第4min时,O2的平均反应速率为__________________。②反应在第6min时改变了条件,改变的条件可能是__________________(填序号)。A.使用催化剂B.升高温度C.减小压强D.增加O2的浓度③下列说法中能说明4NH3(g)+5O2(g)4NO(g)+6H2O(g)达到平衡状态的是__________________(填序号)。A.单位时间内生成nmolNO的同时,生成nmolNH3B.条件一定,混合气体的平均相对分子质量不再变化C.百分含量w(NH3)=w(NO)D.反应速率v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化(3)某...