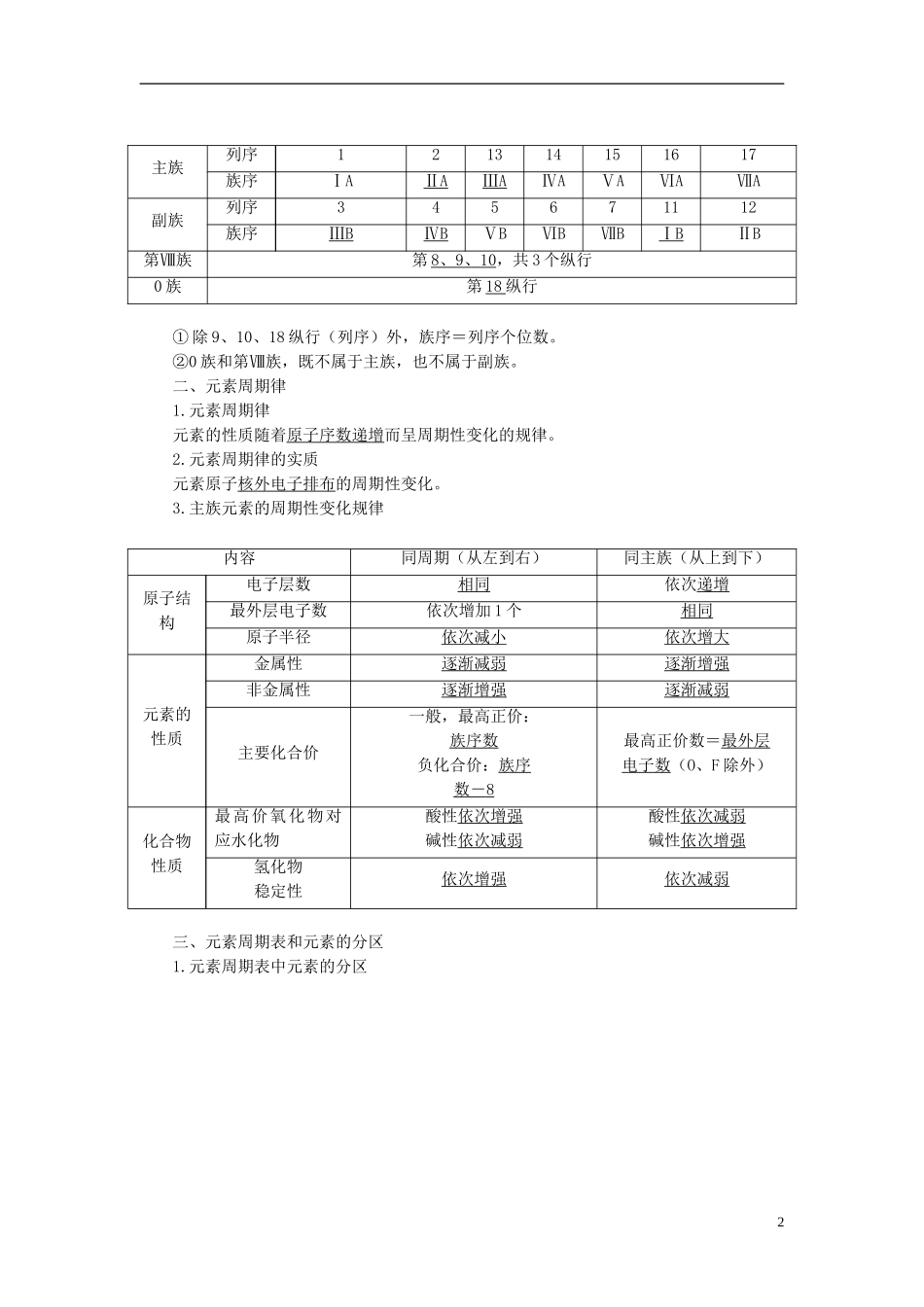
第二节元素周期表元素周期律明考纲要求理主干脉络1.掌握元素周期律的实质。2.了解元素周期表(长式)的结构(周期、族)及其应用。3.了解金属、非金属在元素周期表中的位置及其性质的递变规律。4.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。5.以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。一、元素周期表1.原子序数按照元素在周期表中的顺序给元素所编的序号。原子序数=核电荷数=质子数=核外电子数。2.编排原则横行→周期纵行→族3.结构(1)周期(7个横行,7个周期):(2)族(18个纵行,16个族)1主族列序121314151617族序ⅠAⅡAⅢAⅣAⅤAⅥAⅦA副族列序345671112族序ⅢBⅣBⅤBⅥBⅦBⅠBⅡB第Ⅷ族第8、9、10,共3个纵行0族第18纵行①除9、10、18纵行(列序)外,族序=列序个位数。②0族和第Ⅷ族,既不属于主族,也不属于副族。二、元素周期律1.元素周期律元素的性质随着原子序数递增而呈周期性变化的规律。2.元素周期律的实质元素原子核外电子排布的周期性变化。3.主族元素的周期性变化规律内容同周期(从左到右)同主族(从上到下)原子结构电子层数相同依次递增最外层电子数依次增加1个相同原子半径依次减小依次增大元素的性质金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱主要化合价一般,最高正价:族序数负化合价:族序数-8最高正价数=最外层电子数(O、F除外)化合物性质最高价氧化物对应水化物酸性依次增强碱性依次减弱酸性依次减弱碱性依次增强氢化物稳定性依次增强依次减弱三、元素周期表和元素的分区1.元素周期表中元素的分区2分界线两侧的元素,既能表现出一定的非金属性,又能表现出一定的金属性。2.元素周期表和元素周期律应用的重要意义(1)科学预测:为新元素的发现及预测它们的原子结构和性质提供线索。(2)寻找新材料:将下面左右两侧对应内容连线。1.判断正误(正确的打“√”,错误的打“×”)。(1)最外层电子数是2的元素都是ⅡA族元素。()(2)元素周期表中包含元素种类最多的族是Ⅷ族。()(3)根据最高正化合价与族序数的关系,推出卤族元素最高正价都是+7。()(4)元素周期表中镧系、锕系都占据同一格,它们都是同位素。()(5)元素的性质随相对原子质量的递增呈现周期性的变化。()(6)第3周期非金属元素含氧酸的酸性从左到右依次增强。()提示:(1)×He、Fe等元素不在ⅡA族。(2)×由于镧系、锕系均在ⅢB族,所以元素种类最多的在ⅢB族。(3)×F无正价,故该说法错误。(4)×同位素是同种元素,因此镧系和锕系不属于同位素。(5)×原子序数大,相对原子质量不一定大,因此上述表达是错误的。(6)×应该是最高价含氧酸依次增强,如H2SO4比HClO酸性强。2.请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题(1)标出族序数。(2)画出金属与非金属的分界线;画出过渡元素。(3)标出镧系、锕系的位置。(4)写出各周期元素的种类。(5)写出稀有气体元素的原子序数。(6)标出113号~118号元素的位置。3族周期种类1234567答案:3.依据元素周期律填写下列问题:(1)第3周期元素的金属性:NaMgAl,对应最高价氧化物的水化物的碱性;非金属性:SiPSCl,对应最高价氧化物的水化物的酸性:。(2)碱金属元素:随着元素核电荷数增多,电子层数增,原子半径,失电子能力还原性;单质与水反应;生成的碱的碱性逐渐。(3)卤族元素:随卤素核电荷数的增多,电子层数依次,原子半径逐渐,原子核对电子的吸引力逐渐,得电子能力逐渐,单质的氧化性;单质与氢气反应越来越,生成的气态氢化物的稳定性越来越;最高价含氧酸的酸性。答案:(1)>>NaOH>Mg(OH)2>Al(OH)3<<<H2SiO3<H3PO4<H2SO4<HClO4(2)多增大增强增强越来越剧烈增强(3)增多增大减小减弱减弱难弱减弱4.哪些事实能够说明Na的金属性比Mg的强?哪些事实能说明Cl的非金属性比S的强?提示:(1)Na、Mg与水反应时,Na与冷水剧烈反应Mg不易与冷水反应;NaOH比Mg(OH)2碱性强。(2)Cl2与H2反应比S与H2反应容易,前者点燃或光照,后者需加热且反应可逆;HCl比H2S稳定;HClO4酸性比H2SO4强;Cl2...