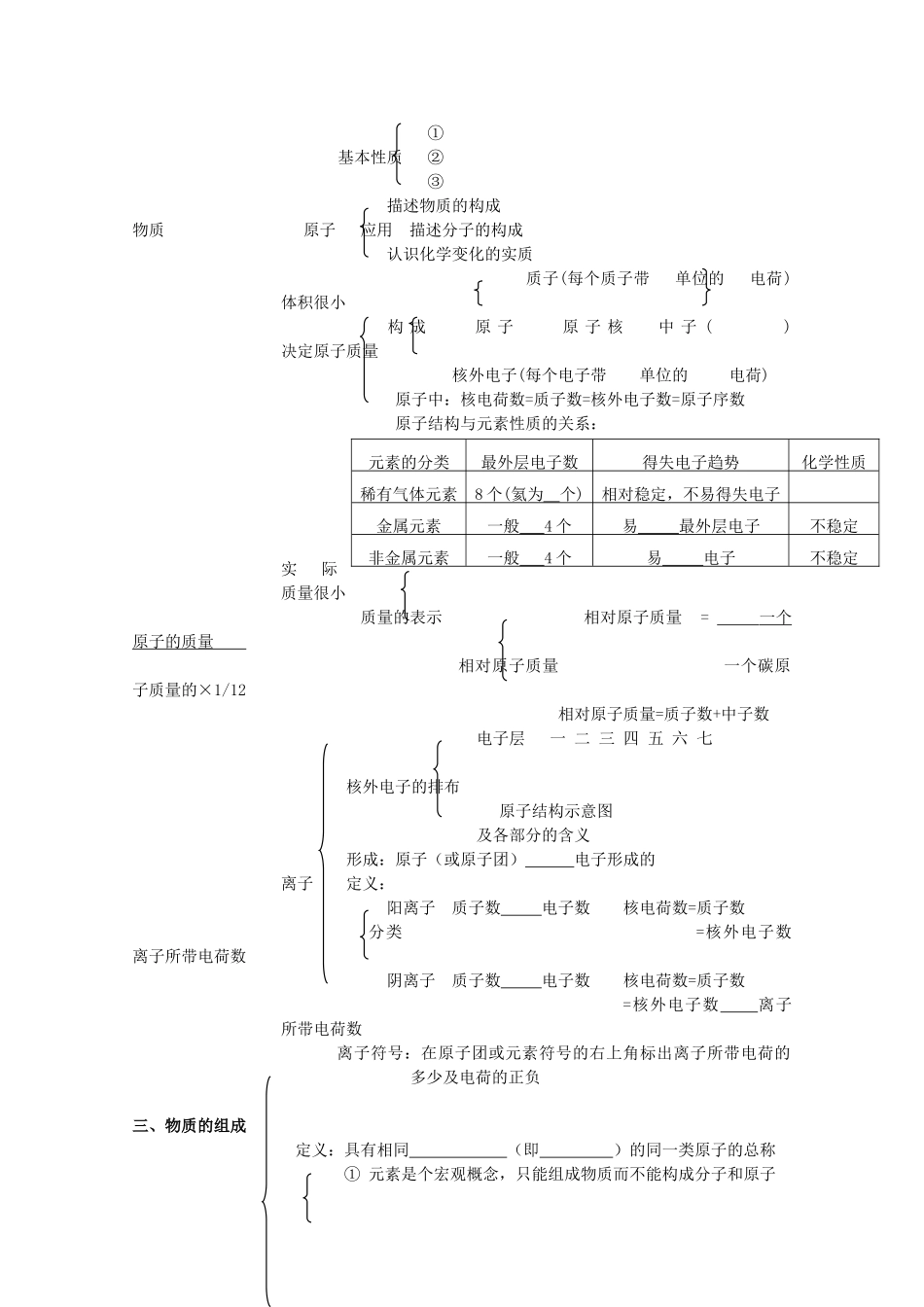
一、物质的分类:混合物:空气、合金、溶液(无化学式)微观构成:含多种分子或原子金属一些非金属固体单质元素符号表示——由原子构成单质稀有气体(化学式里只有一种元素符号)常见气体元素符号物质另一些固体非金属单质和角码表示纯净物氢化物(一定由两种元素组成,(有化学式)其中一种是氢,氢化物一般是氢在前,特殊:NH3、CH3等)根据分子中是含氧酸由分子构成酸:H和酸根组成否含有氧原子无氧酸根据分子中数一元酸氢原子的个二元酸无机物三元酸非金属氧化物氧化物(一种是氧元素,(一定由两种元素一种是非金属元素)组成,其中一种是化合物氧,氧化物氧在后)金属氧化物(化学式里有两种或(一种是氧元素,两种以上的元素符号)一种是金属元素)由离子构成碱:金属阳离子(包括NH4+)可溶性碱和OH—构成不溶性碱正盐盐:金属阳离子和酸根离子酸式盐碱式盐有机物:绝大多数含碳化合物二、物质的构成定义:①基本性质②分子③④同种物质的分子性质相同,不同种物质的分子性质不同描述物质的构成应用认识物理变化和化学变化解释生产生活实际中的一些现象定义:①基本性质②③描述物质的构成物质原子应用描述分子的构成认识化学变化的实质质子(每个质子带单位的电荷)体积很小构成原子原子核中子()决定原子质量核外电子(每个电子带单位的电荷)原子中:核电荷数=质子数=核外电子数=原子序数原子结构与元素性质的关系:实际质量很小质量的表示相对原子质量=一个原子的质量相对原子质量一个碳原子质量的×1/12相对原子质量=质子数+中子数电子层一二三四五六七核外电子的排布原子结构示意图及各部分的含义形成:原子(或原子团)电子形成的离子定义:阳离子质子数电子数核电荷数=质子数分类=核外电子数离子所带电荷数阴离子质子数电子数核电荷数=质子数=核外电子数离子所带电荷数离子符号:在原子团或元素符号的右上角标出离子所带电荷的多少及电荷的正负三、物质的组成定义:具有相同(即)的同一类原子的总称①元素是个宏观概念,只能组成物质而不能构成分子和原子元素的分类最外层电子数得失电子趋势化学性质稀有气体元素8个(氦为个)相对稳定,不易得失电子金属元素一般4个易最外层电子不稳定非金属元素一般4个易电子不稳定性质②元素只讲种类,不讲个数,不能讲几个元素概念③在化学变化中,元素的种类和质量保持不变分类物质的组成在地壳中:前五位在空气中:元素最多,其次是元素含量在生物体中:前三位在宇宙中:元素最多元素写法:用拉丁文名称的第一个字母来表示元素,如果集中元素名称的表示方法——元素符号第一个字母相同时,可再附加一个小写字母来区别①宏观意义:意义②微观意义:元素周期表:根据元素的原子结构和性质,把现在已知的一百多种元素按元素周期表原子序数(核电荷数)科学有序的排例起来,这样的表叫做元素周期表每一格结构每一横行(周期)每一纵行(即族)①是学习和研究化学知识的重要工具意义②为寻找新元素提供了理论依据③在元素周期表中位置越靠近的元素,性质越相似,可以启发人们在元素周期表的一定区域寻找新物质(如农药、催化剂、半导体材料等)单质应用元素角度认识化合物氧化物物质、元素、分子、原子的区别和联系元素物质(宏观概念)只讲种类,不讲个数原子分子(微观概念)既讲种类,又讲个数四、物质组成的表示概念:用元素符号来表示物质组成的式子宏观意义化学式微观单质书写化合物读法概念理解:不同元素形成化合物时原子个数比固定的数值,单质中元素的化合价为离子化合物物质组成化合物的表示共价化合物规则:正、负化合价代数和为零化合价常见化合价:化合价口诀<一><二>单质元素全为零,化合物中记分明。正一氢钠钾和银,氟氯溴碘负一寻。一价钾钠氢银铵,钡镁钙锌二价占。二价氧镁钙钡锌,三铝四硅五价磷。一二铜汞、一三金,二四锡铅锰与碳。四二是碳三二铁,一二铜汞一三金,三价铝,四价硅,二四六价硫占满。硫逢双价二四六,锰为二四六和七,氯负一,氧负二,铁有正二和正三。单质规定为零价。氢氧根显负一,负三正五是磷氮。酸根所有皆为负,一硝三磷二硫碳。求化合价应用判断化学式的正误书写化学式交叉法书写化合物...