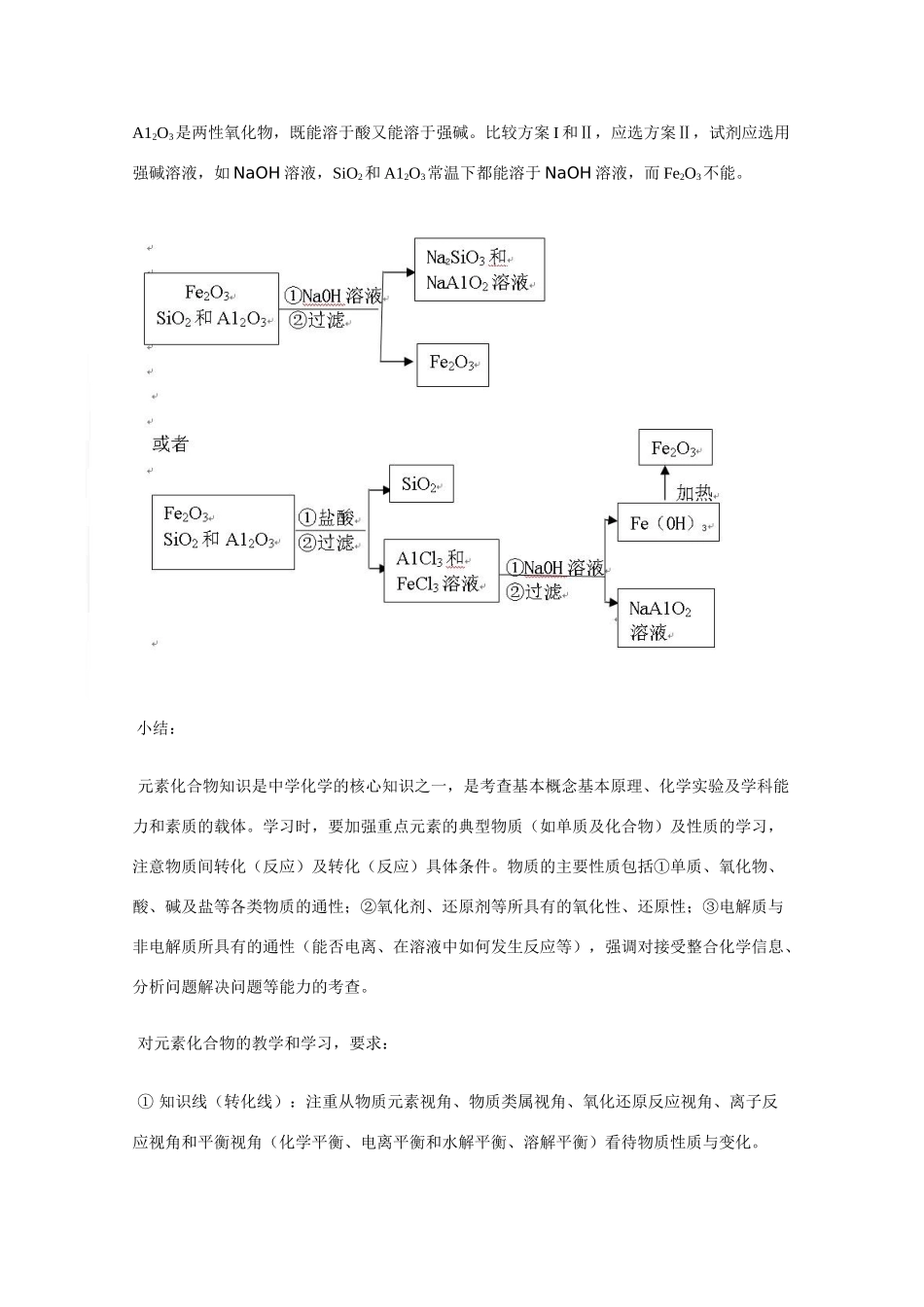
解读考试说明,评析高考试题,发现试卷特点,探索备考策略(之四)第二卷评析(2)(题目)16.(9分)下图表示从固体混合物中分离X的2种方案,请回答有关问题。(1)选用方案I时,X应该具有的性质是,残留物应该具有的性质是;(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是,有关反应的化学方程式为;(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)。(评析)属中等偏难的题目。是以元素化合物知识为载体的实验探究题,试题以物质分离操作流程为情景,突出考查物质性质在分离提纯中的应用:⑴要求根据物质分离方案,推断物质具有的性质;⑵根据物质性质确定分离提纯方案;⑶根据物质性质综合设计提纯物质流程图。注考生思维敏捷性、缜密性、统摄性、灵活性和创造性的考查。层次:(常见无机物及其应用)常见元素【常见金属元素(如Na、Al、Fe、Cu等和常见非金属元素(如H、C、N、O、Si、S、Cl等))的单质及化合物知识的综合应用。解析:题目以无机混合物分离为切入点预测物质的性质,判断物质之间的反应,比较物质的性质并加以应用,设计混合物的分离方案。方案I,将含X的混合物加热就可以分离为X和残留物,说明X可能具有的性质有:①挥发性,②易升华;残留物应具有良好的热稳定性,加热不升华、不挥发。方案Ⅱ,向含X的混合物中加入试剂并过滤,可分离出X,说明X不溶于该试剂或者不反应。从含有Au、Ag和Cu的混合物中分离Au,比较三种金属的活动性:Ag和Cu是较不活泼金属,不能与盐酸、稀硫酸反应,和浓硫酸反应需要加热,常温下能与硝酸反应;Au是不活泼金属,与盐酸、硫酸、硝酸都不反应。因此从含有Au、Ag和Cu的混合物中分离Au,应选用硝酸做试剂,不论浓稀都能与Ag和Cu反应,剩余Au,再过滤即可分离出。有关反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2OAg+2HNO3(浓)=AgNO3+NO2↑+H2O或3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O第(3)问,从Fe2O3、SiO2和A12O3三种氧化物的混合物中提纯Fe2O3,比较三种物质性质,可知都具有良好的热稳定性,Fe2O3是碱性氧化物,能溶于酸;SiO2是酸性氧化物,能溶于碱;A12O3是两性氧化物,既能溶于酸又能溶于强碱。比较方案I和Ⅱ,应选方案Ⅱ,试剂应选用强碱溶液,如NaOH溶液,SiO2和A12O3常温下都能溶于NaOH溶液,而Fe2O3不能。小结:元素化合物知识是中学化学的核心知识之一,是考查基本概念基本原理、化学实验及学科能力和素质的载体。学习时,要加强重点元素的典型物质(如单质及化合物)及性质的学习,注意物质间转化(反应)及转化(反应)具体条件。物质的主要性质包括①单质、氧化物、酸、碱及盐等各类物质的通性;②氧化剂、还原剂等所具有的氧化性、还原性;③电解质与非电解质所具有的通性(能否电离、在溶液中如何发生反应等),强调对接受整合化学信息、分析问题解决问题等能力的考查。对元素化合物的教学和学习,要求:①知识线(转化线):注重从物质元素视角、物质类属视角、氧化还原反应视角、离子反应视角和平衡视角(化学平衡、电离平衡和水解平衡、溶解平衡)看待物质性质与变化。②方法线:突出应用分类、对比(类比)、实验、归纳等的方法研究、整合、提炼物质的性质。③价值线:强调用联系的观点、转化的观点、微粒的观点、持续发展的观点看待物质的性质与应用。注意研究往年高考试题,探索命题立意、考查重点,思考和领悟命题对知识的拓展方向、学习潜能考查,感知命题创新。在学习和进行复习时,要重视教材的价值。(题目)17.(9分)某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。(1)A的分子式为:(2)A与溴的四氯化碳溶液反应的化学方程式为,反应类型是;(3)已知:。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式;(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式;(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为。(评析)中等难度题。这是一道有机推断题,基本属于新课标有机化学必修部分的内容...