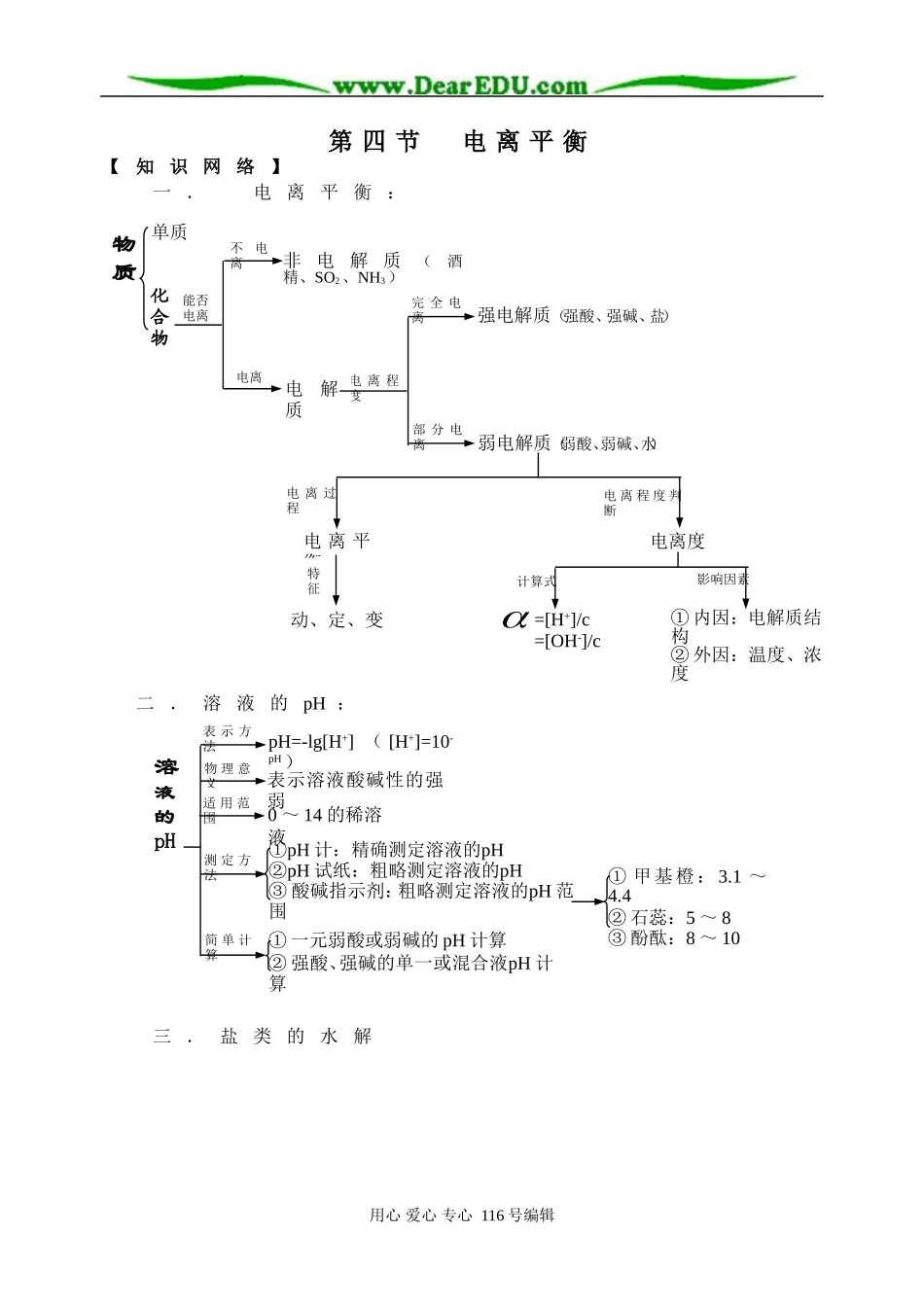
第四节电离平衡【知识网络】一.电离平衡:二.溶液的pH:三.盐类的水解用心爱心专心116号编辑强电解质(强酸、强碱、盐)化合物能否电离物质单质电离程度电离不电离非电解质(酒精、SO2、NH3)电解质完全电离部分电离弱电解质(弱酸、弱碱、水)①内因:电解质结构②外因:温度、浓度电离平衡电离过程电离程度判断电离度动、定、变特征计算式=[H+]/c=[OH-]/c影响因素①一元弱酸或弱碱的pH计算②强酸、强碱的单一或混合液pH计算①甲基橙:3.1~4.4②石蕊:5~8③酚酞:8~10①pH计:精确测定溶液的pH②pH试纸:粗略测定溶液的pH③酸碱指示剂:粗略测定溶液的pH范围0~14的稀溶液表示溶液酸碱性的强弱溶液的pH表示方法物理意义适用范围测定方法简单计算pH=-lg[H+]([H+]=10-pH)四.中和滴定用心爱心专心116号编辑①判断离子浓度;②判断离子共存;③判断弱电解质强弱;④盐溶液配制;⑤物质的鉴别与除杂;⑥制备胶体;⑦明矾净水;⑧泡沫灭火机原理、草木灰不能与铵态氮肥混合使用;⑨试剂存放:如NH4F溶液不能用玻璃瓶保存;⑩判断水解盐受热产物内因:水解生成的弱电解质“越弱”,水解程度越大外因:①温度:升温有利水解;②浓度:越稀越水解;③外加酸或碱:抑制或促进水解①为可逆反应;②水解程度是微弱的单离子水解:①水写分子式(不能写成H+或OH-),中间用可逆(用不能用=),后无沉气出(不能用↑、↓);②多元弱酸根要分步写;③阳离子水解一般一步写离子方程式书写是水的电离平衡发生移动,改变了[H+]与[OH-]相对大小,使溶液呈酸性或碱性实质类型规律特征影响因素应用盐类水解①强酸强碱盐—只溶解,不水解,溶液呈中性②强碱弱酸盐—多元弱酸根分步水解,溶液呈碱性③强酸弱碱盐—阳离子水解,溶液呈酸性④弱酸弱碱盐—水解后溶液的酸碱性由弱酸根和弱碱的相对强弱决定⑤完全水解—有沉淀、气体生成:如Al3++3HCO3-=Al(OH)3↓+3CO2↑谁弱谁水解,谁强显谁性;越弱越易水解,双弱双水解,不弱不水解;盐对应的酸(碱)越弱,水解程度越大,溶液碱(酸性)越强。①准备:查漏、洗涤、润洗、装液、排气泡、调液面读数②滴定:取待测液、加指示剂、滴定、判终点读数③计算:取2~3次耗标准液的平均值,求待测液浓度①作用:由指示剂的颜色的改变来确定滴定终点②用量:1~2滴③选择要求:⑴变色明显易于观察;⑵变色范围越窄越好;⑶变色范围与终点pH吻合或接近①酸式滴定管(不能盛放碱液)②碱式滴定管(不能盛放酸液和氧化性溶液如KMnO4)③锥形瓶、铁架台、滴定管夹、烧杯①准确测定参加反应的酸或碱液的体积②准确判断中和反应是否恰好进行完全(滴定终点判断)由标准液和待测液反应,用指示剂反应来确定“滴定终点”,据方程式求待测液的浓度原理关键中和滴定仪器指示剂操作【易错指津】1.判断电解质和非电解质(1)电解质和非电解质必须是化合物,不能是单质也不能是混合物。(2)电解质是溶质本身能电离。就是说:其水溶液能导电者,它不一定是电解质。如:SO2和CO2等都不是电解质。(3)在水中不导电的化合物,不一定不是电解质。如:BaSO4、CaCO3等难溶盐,因为其溶解度太小,导电性不易测出。但所溶解的极少部分,却能全部电离生成离子,故均为强电解质。2.解题过程的有序性,是完成电解质溶液的有关试题中应加以注意的一个方面:如在弱电解质溶液稀释、强酸或强碱的相互反应、酸碱的相互反应等,都应分层次地逐一分析外界条件的变化、平衡移动对所研究体系造成的影响。如两强碱溶液相混合后,求溶液pH时,一定用[OH-]计算,绝对不能颠倒。例:将pH=10NaOH溶液和pH=12NaOH溶液等体积混合,求所得溶液的[H+]。许多同学往往直接加以计算:[H+]=(10-10+10-12)/2。注意在混合过程中[H+]、[OH-]的变化:[H+]=(10-10+10-12)/2=1/2×10-10,[OH-]=(10-2+10-4)/2=1/2×10-10,[H+][OH-]>Kw,平衡将向生成水的方向移动,导致[H+]、[OH-]下降,并将对[H+]造成较大的影响,但对[OH-]的影响不大,因而混合溶液中[H+]的计算,应由混合溶液中[OH-],再通过水的离子积算出。3.离子浓度的大小判断的试题中应结合溶液中存在的电荷守恒、溶液的pH逐步分析。在对等体积...