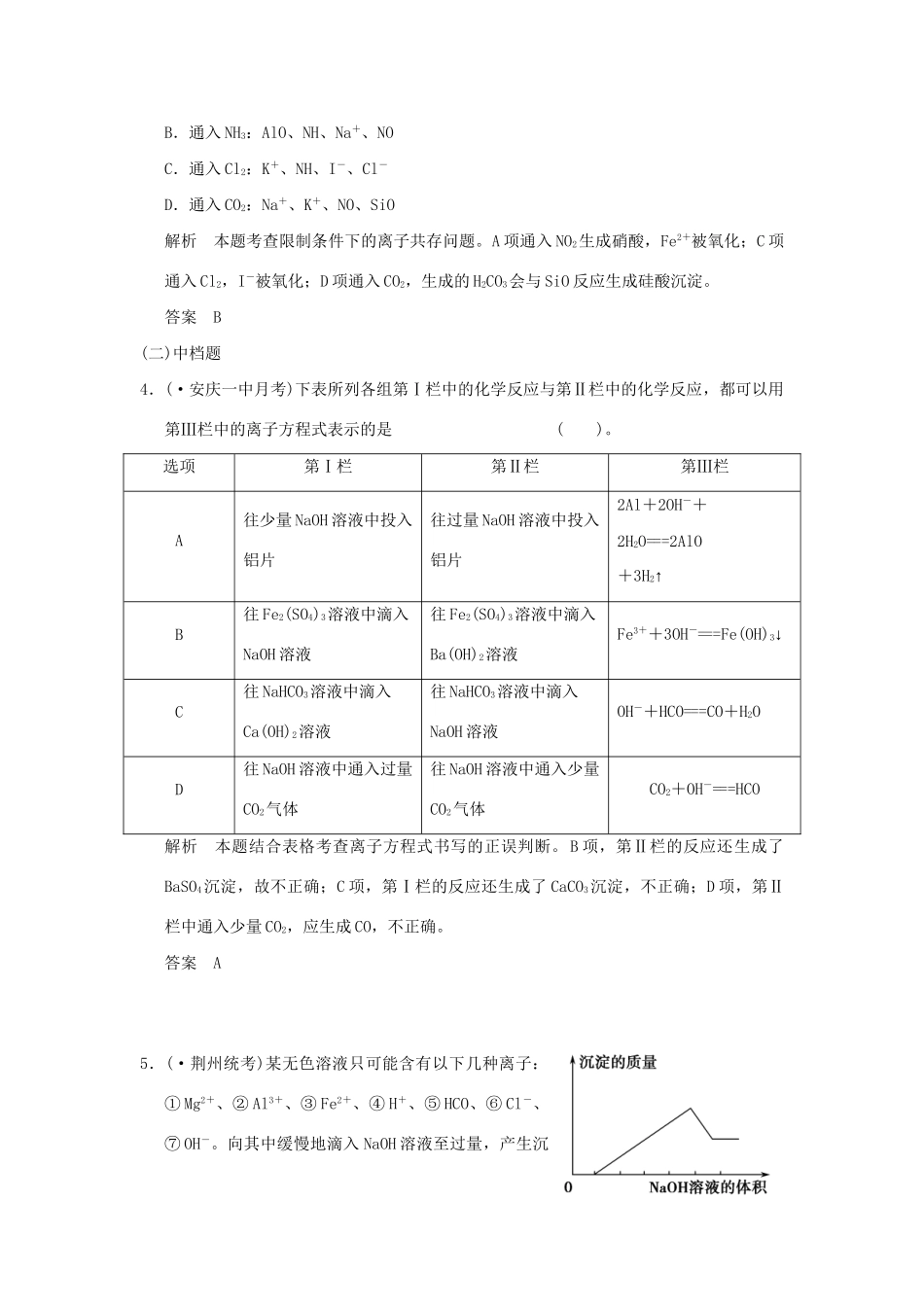
专题三中学化学常见的两种重要反应类型(时间:45分钟类型:(7+4)专项训练)一、6分选择题专项训练(一)低档题1.下列各组物质中只具有还原性的是()。A.F-、CO、NaB.Na、I-、ZnC.Fe3+、SO、NOD.Fe3+、O2、H2O2解析Na、Zn是金属单质,只具有还原性,I-处于最低价态,也只具有还原性。答案B2.下列说法正确的是()。A.根据反应Cu+H2SO4=====CuSO4+H2↑可推出Cu的还原性比H2的强B.在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂C.反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生解析电解过程是非自发的氧化还原反应,不能根据电解方程式来判断物质氧化性和还原性强弱,A项错误;B项中发生的是氢元素的归中反应,水中的氢元素化合价降低,水作氧化剂,正确;C项中氮元素发生歧化反应,氧化剂和还原剂的物质的量之比是1∶2,错误;D项中碘单质将+5价的氯元素还原为氯气,说明碘单质的还原性强于氯气的,遵循氧化还原反应规律,错误。答案B3.(·太原统考)向含有下列各组离子的溶液中通入相应气体后,能大量共存的是()。A.通入NO2:Na+、Fe2+、Cl-、SOB.通入NH3:AlO、NH、Na+、NOC.通入Cl2:K+、NH、I-、Cl-D.通入CO2:Na+、K+、NO、SiO解析本题考查限制条件下的离子共存问题。A项通入NO2生成硝酸,Fe2+被氧化;C项通入Cl2,I-被氧化;D项通入CO2,生成的H2CO3会与SiO反应生成硅酸沉淀。答案B(二)中档题4.(·安庆一中月考)下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是()。选项第Ⅰ栏第Ⅱ栏第Ⅲ栏A往少量NaOH溶液中投入铝片往过量NaOH溶液中投入铝片2Al+2OH-+2H2O===2AlO+3H2↑B往Fe2(SO4)3溶液中滴入NaOH溶液往Fe2(SO4)3溶液中滴入Ba(OH)2溶液Fe3++3OH-===Fe(OH)3↓C往NaHCO3溶液中滴入Ca(OH)2溶液往NaHCO3溶液中滴入NaOH溶液OH-+HCO===CO+H2OD往NaOH溶液中通入过量CO2气体往NaOH溶液中通入少量CO2气体CO2+OH-===HCO解析本题结合表格考查离子方程式书写的正误判断。B项,第Ⅱ栏的反应还生成了BaSO4沉淀,故不正确;C项,第Ⅰ栏的反应还生成了CaCO3沉淀,不正确;D项,第Ⅱ栏中通入少量CO2,应生成CO,不正确。答案A5.(·荆州统考)某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是()。A.①②⑤B.①③④C.②⑥⑦D.①②④⑥解析本题结合图像考查限制条件下的离子共存问题。Fe2+的溶液为浅绿色,则含③的选项可以排除,即排除选项B;滴加氢氧化钠溶液,开始时没有沉淀生成,可推知溶液中含有较多的H+,则含⑦OH-和⑤HCO的选项可以排除,故排除A、C选项;生成沉淀的量先增加后减少且最终沉淀不完全溶解,可推知溶液中含有Al3+、Mg2+,再由溶液呈电中性可推知一定含有Cl-,选项D正确。答案D6.(·湖南四校联考)某溶液中含有NO、SiO、AlO、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是()。A.只有S2-B.S2-和NOC.SiO、S2-和NOD.4种离子都减少解析本题通过实验探究4种离子的反应情况,考查离子反应的本质。解答时根据H+、Cl-、Na+、OH-与4种离子的性质,推断出离子数目大量减少的离子。加入过量盐酸,NO(H+)氧化S2-,从而导致NO和S2-的数目大量减少,而SiO、AlO与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+分别与过量的OH-反应又生成SiO和AlO,数目几乎不变。答案B7.(·金华质检)在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是()。A.在该反应中碘酸钠作还原剂B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性C.反应中生成1molNa2H3IO6转移2mol电子D.反应中氧化产物与还原产物的物质的量之比为2∶1解析本题考查氧化还原反应,难度中等。碘酸钠中碘元素的化合价升高,作为...