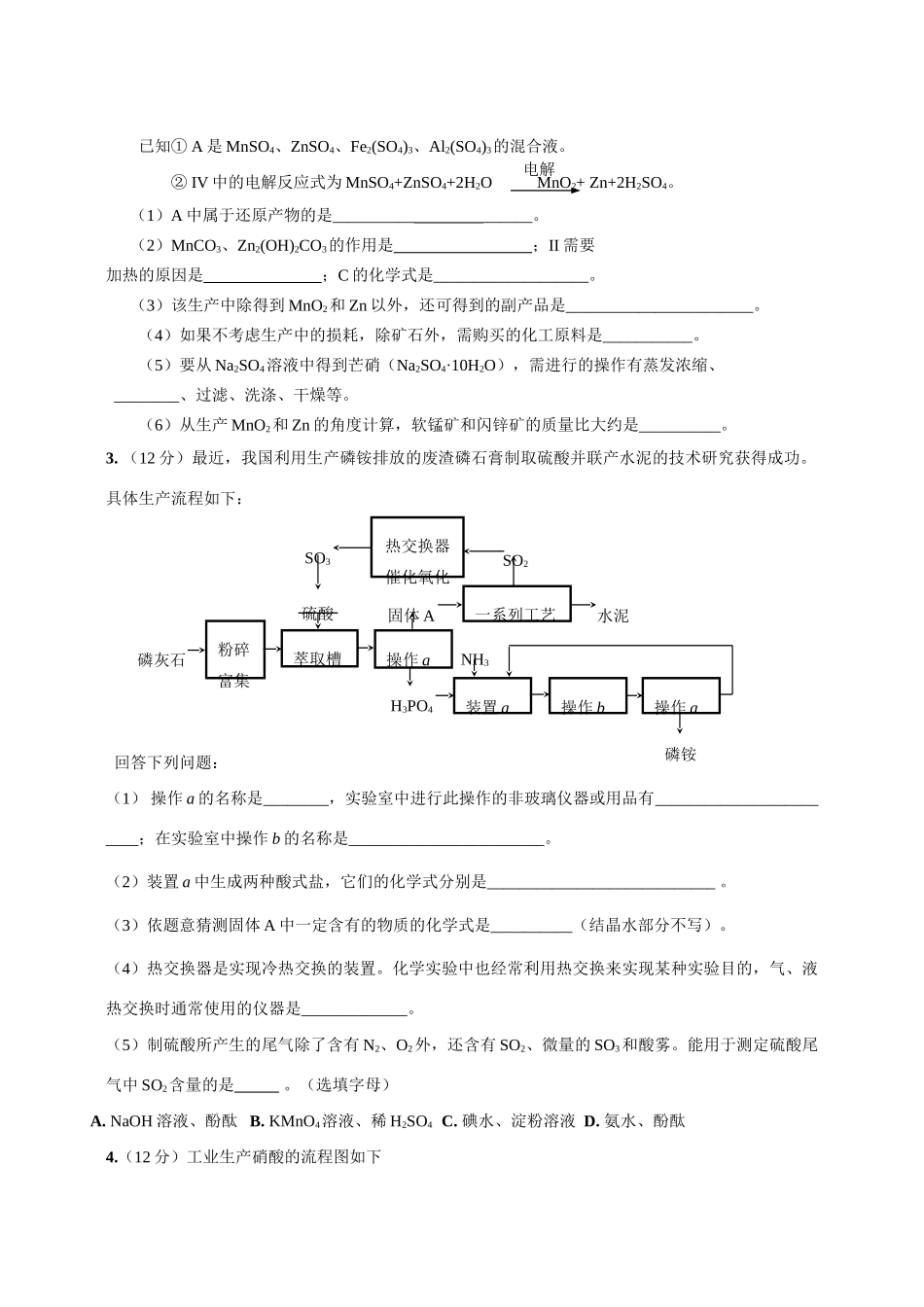
稀硫酸、闪锌矿粉、软锰矿粉加热、浸取(I)AB(III)加热(II)电解(IV)Na2SO4过滤,回收S过滤、灼热,回收Fe2O3、Al2O3MnCO3、Zn2(OH)2CO3回收MnO2、ZnCNa2CO3潮州市金山中学高三化学练习题(化工)2009-3-251.(9分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的原理是:△H<0,生产流程如右图所示。①X的化学式为;②右图中条件选定的主要原因是(选填字母序号);A.升高温度、增大压强均有利于氨的合成B.铁触媒在该温度时活性大C.工业生产受动力、材料、设备等条件的限制③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号),当横坐标为温度时,变化趋势正确的是(选填字母序号)。(2)常温下氨气极易溶于水,其水溶液可以导电。④用方程式表示氨气溶于水且显弱碱性的过程:;⑤氨水中水电离出的c(OH-)10-7mol·L-1(填写“>”、“<”或“=”);⑥将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为。2.(12分)某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):电解已知①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。②IV中的电解反应式为MnSO4+ZnSO4+2H2OMnO2+Zn+2H2SO4。(1)A中属于还原产物的是________________。(2)MnCO3、Zn2(OH)2CO3的作用是;II需要加热的原因是;C的化学式是___________________。(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_______________________。(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。3.(12分)最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如下:回答下列问题:(1)操作a的名称是________,实验室中进行此操作的非玻璃仪器或用品有________________________;在实验室中操作b的名称是________________________。(2)装置a中生成两种酸式盐,它们的化学式分别是____________________________。(3)依题意猜测固体A中一定含有的物质的化学式是__________(结晶水部分不写)。(4)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是_____________。(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是。(选填字母)A.NaOH溶液、酚酞B.KMnO4溶液、稀H2SO4C.碘水、淀粉溶液D.氨水、酚酞4.(12分)工业生产硝酸的流程图如下水泥SO3SO2固体ANH3H3PO4粉碎富集萃取槽磷灰石硫酸操作a装置a操作b操作a磷铵热交换器催化氧化一系列工艺请回答下列问题:(1)写出硝酸在工农业生产中的重要作用_______________________(任写一条)。(2)已知N2(g)+3H2(g)2NH3(g);ΔH=-92.4kJ·mol-1。请回答:①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl时引起平衡移动的条件可能是。其中表示平衡混合物中NH3的含量最高的一段时间是。②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的数值为。(3)氨催化氧化的化学方程式为_________________________,该反应是放热反应,当温度升高时,反应的化学平衡常数K值____(增大、减小、无影响)。(4)工业上常用纯碱溶液来吸收硝酸厂尾气中的二氧化氮,吸收产物中有亚硝酸钠、硝酸钠和二氧化碳,该化学方程式为__________;还可以利用氢气在催化剂下把氮的氧化物还原为____和水。5.(11分)氯碱工业中,通过电解饱和食盐水获得重要的化工原料,其产物中的氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、聚氯乙烯、氯苯等。(1)电解食盐水的离子方程式为。氯气用...