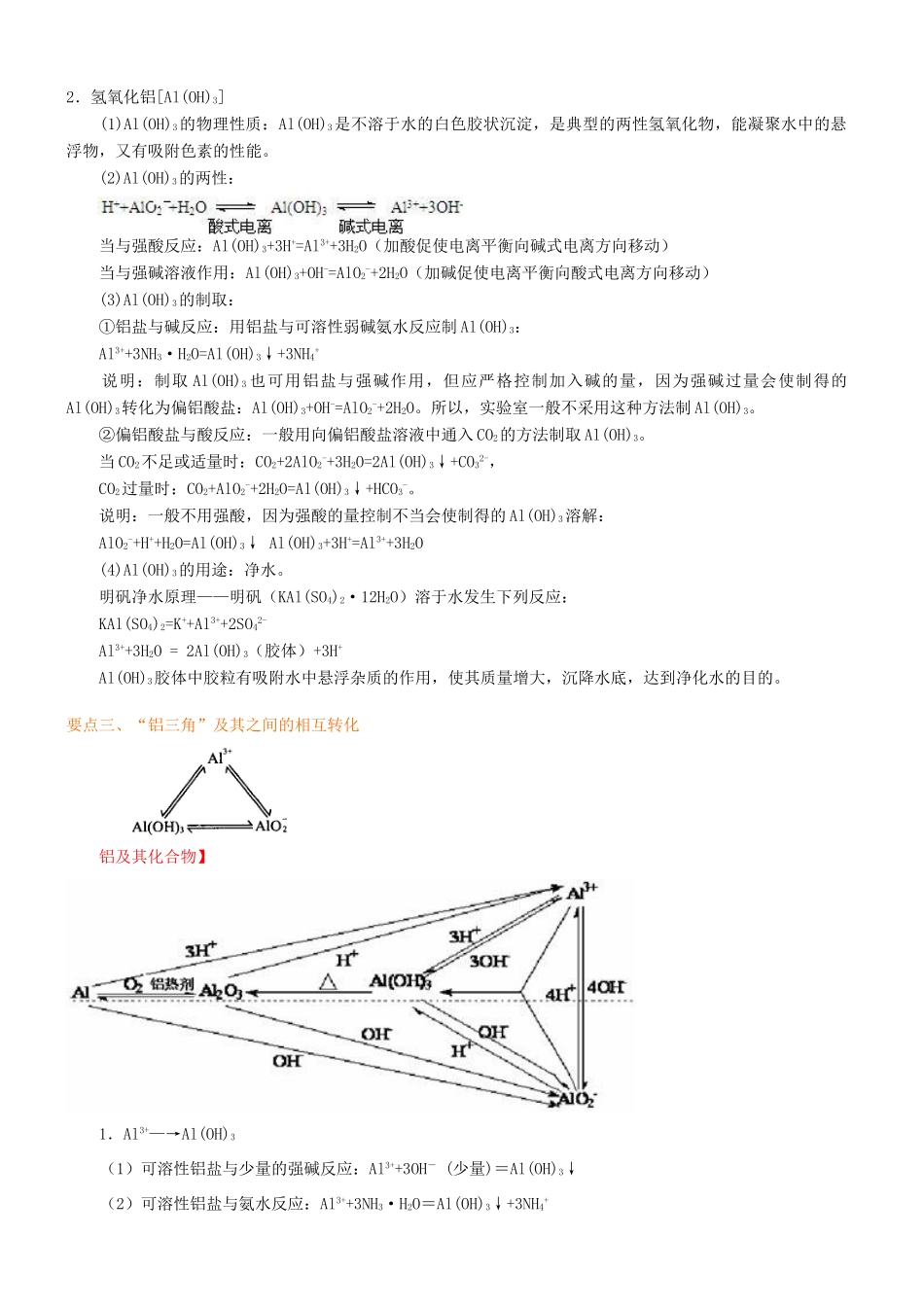
铝及其化合物 【学习目标】1、铝的性质;2、铝的重要化合物及其相互转化。 【要点梳理】要点一、铝1.铝的原子结构和物理性质:元素符号原子结构原子半径化合价颜色密度(g·cm-3)熔点℃沸点℃硬度13Al1.43×10-10m+3银白色2.70660.42467较软2.化学性质 Al-3e-=Al3+ (1)与非金属反应: a、铝与氧气的反应。铝及其化合物】实验探究:加热有氧化膜和无氧化膜的铝箔实验步骤实验现象实验结论(1)用坩埚钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动,仔细观察铝箔熔化,失去光泽,熔化的铝并不滴落在常温下,铝能与空气中的氧气反应,生成一层致密的氧化物薄膜。加热时反应加剧,生成白色固体,放出大量的热,4Al+3O22Al2O3铝是一种活泼金属,构成薄膜的 Al2O3 的熔点(2050℃)高于 Al 的熔点(660℃)(2)另取一块铝箔,用砂纸仔细打磨(或在酸中处理后,用水洗净),除去表面的保护膜,再加热至完全熔化,观察现象 b、与其它非金属反应: 2Al+3S Al2S3 2Al+3Cl2 2AlCl3 (2)与酸反应: (3)与碱反应2Al+2H2O+2NaOH=2NaAlO2+3H2↑ 2Al+2H2O+2OH-=2AlO2-+3H2↑要点诠释:① 铝是一种较活泼的金属,它并不直接与碱反应,铝与氢氧化钠溶液的反应,实际分两步进行:首先要铝与水反应:2Al+6H2O=2Al(OH)3↓+3H2↑……①由于生成的 Al(OH)3覆盖在 Al 的表面,故看不到 H2的生成;其次是生成的 Al(OH)3是两性氢氧化物,它溶于 NaOH:Al(OH)3+NaOH=NaAlO2+2H2O……②所以铝与 NaOH 溶液反应可以看到有气体产生。将两反应式按① +②×2 合并,即得总反应式:2Al+2H2O+2NaOH= 2NaAlO2+3H2↑。所以在上述反应中 Al 是还原剂,H2O 是氧化剂。其电子转移情况可表示如下: ②Al 与酸、碱反应产生同量的 H2,消耗 Al 的物质的量之比为 1∶1,消耗盐酸和 NaOH 的物质的量之比为3∶1。③ 酸、碱、盐可直接侵蚀铝的保护膜(氧化铝也能与酸或碱反应)以及铝制品本身,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。 ④铝热反应:Al +MxOy Al2O3+xM 铝热反应的应用:冶炼高熔点金属,如 Fe、V、Cr、Mn 等或焊接钢轨。3.用途:铝主要用来制轻合金。要点二、铝的化合物1.氧化铝(Al2O3) (1)物理性质:白色难熔固体、不溶于水。 (2)化学性质:Al2O3是典型的两性氧化物,既能与酸反应又能与强碱溶液反应。 与强酸:Al2O3+6H+=2Al3++3H2O 与强碱:Al2O3+2OH-=2AlO2-+H2O (3)用途:耐火...