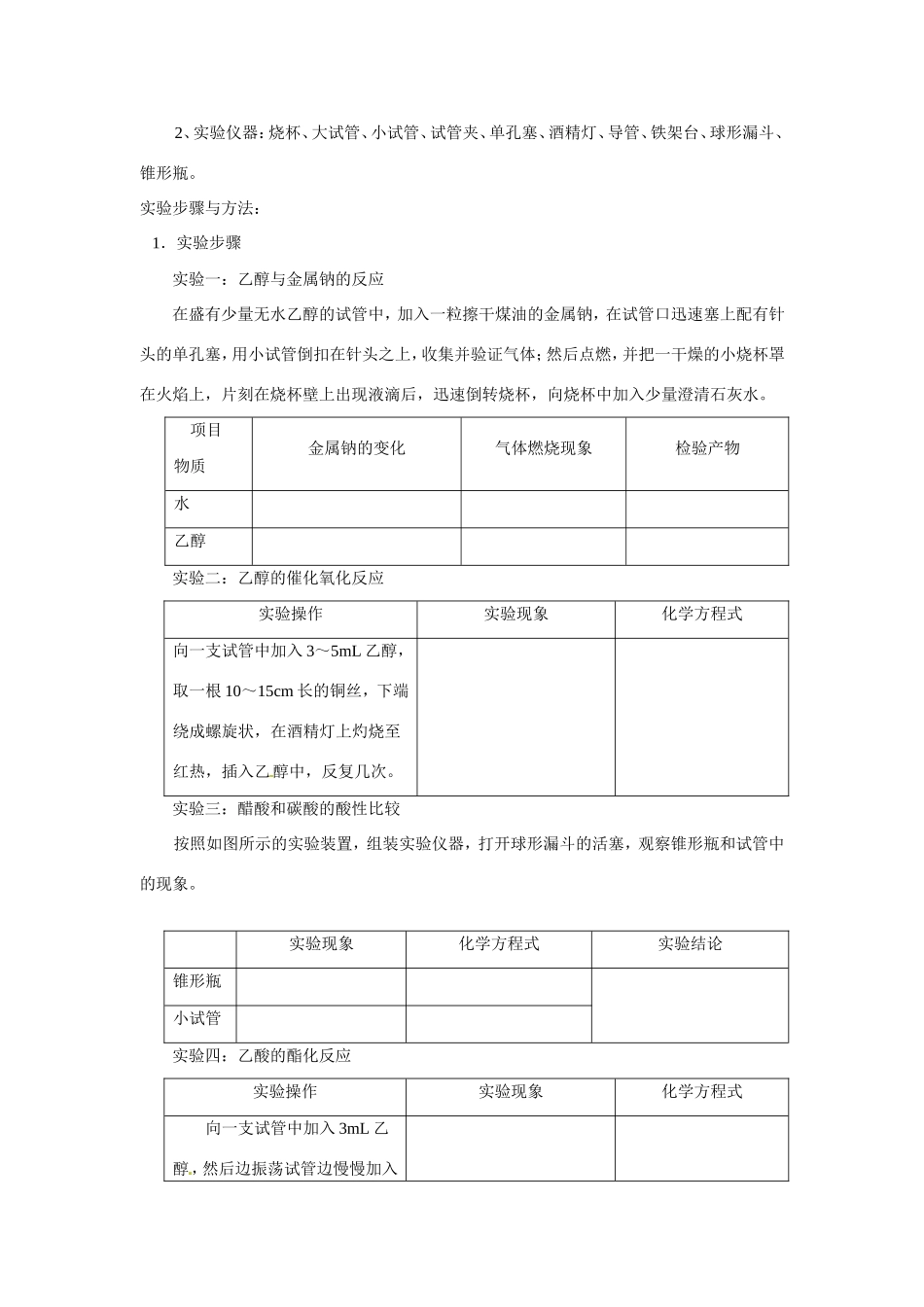
乙醇和乙酸的性质实验报告知识储备:在乙醇的分子结构中,存在五种类型的共价键,其结构如右图所示。乙醇的化学性质主要由羟基决定,碳氧键和氧氢键容易断裂,主要有置换反应、氧化反应、酯化反应等。1.置换反应乙醇能够与活泼金属(如金属钠)发生置换反应,反应过程中乙醇断裂的化学键为①,化学方程式为:2CH3CH2OH+2Na2CH3CH2ONa+H2↑。2.氧化反应乙醇在铜或银做催化剂的条件下,可以被空气中的氧气氧化为乙醛,反应过程中乙醇断裂的化学键为①③,化学方程式为:。3.酯化反应乙醇在浓硫酸的催化作用下与乙酸发生酯化反应,反应过程中乙醇断裂的化学键为①,化学方程式为:。注意事项:1、乙醇与金属钠的反应中金属钠颗粒要大些,实验前吸干钠表面的煤油。2、乙醇的催化氧化反应中铜丝要绕成螺旋状,乙醇的用量要少。3、乙酸的酯化反应中要注意试剂的加入顺序,先加入乙醇,再加入浓硫酸,后加入乙酸。4、乙酸的酯化反应中取用和添加浓硫酸时要注意安全,防止皮肤接触浓硫酸。5、乙酸的酯化反应中要防止倒吸,可以将吸收装置改为导管连接干燥管,干燥管下端插入液面以下。过程展现:实验日期:指导教师:同组人:实验评价:实验目的:掌握金属钠取用的相关操作、掌握乙醇与金属钠的反应、掌握乙醇的氧化反应、掌握乙酸的酯化反应。实验用品:1、实验药品:无水乙醇、钠、澄清石灰水、铜丝、食醋、浓硫酸、乙酸、饱和碳酸钠溶液2、实验仪器:烧杯、大试管、小试管、试管夹、单孔塞、酒精灯、导管、铁架台、球形漏斗、锥形瓶。实验步骤与方法:1.实验步骤实验一:乙醇与金属钠的反应在盛有少量无水乙醇的试管中,加入一粒擦干煤油的金属钠,在试管口迅速塞上配有针头的单孔塞,用小试管倒扣在针头之上,收集并验证气体;然后点燃,并把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量澄清石灰水。项目物质金属钠的变化气体燃烧现象检验产物水乙醇实验二:乙醇的催化氧化反应实验操作实验现象化学方程式向一支试管中加入3~5mL乙醇,取一根10~15cm长的铜丝,下端绕成螺旋状,在酒精灯上灼烧至红热,插入乙醇中,反复几次。实验三:醋酸和碳酸的酸性比较按照如图所示的实验装置,组装实验仪器,打开球形漏斗的活塞,观察锥形瓶和试管中的现象。实验现象化学方程式实验结论锥形瓶小试管实验四:乙酸的酯化反应实验操作实验现象化学方程式向一支试管中加入3mL乙醇,然后边振荡试管边慢慢加入2mL乙酸,用酒精灯缓慢加热,将产生的蒸气经导管通到饱和碳酸钠溶液的液面上。2、实验结论将实验过程中的相关实验现象填入实验报告中的空白栏中,并与其他同学进行交流。反思与探究:1.白酒和白醋是厨房中常用的调味品的,试设计一简单实验进行区别,要求写出实验方法、现象和结论。2.比较金属钠与乙醇、水的反应的剧烈程度,反应的剧烈程度说明什么问题?3.乙醇的氧化反应中铜丝的作用是什么?为什么要将铜丝绕成螺旋状?4.将铜丝在酒精灯外焰上灼烧后,铜丝变黑,再将变黑的铜丝伸入到酒精灯的焰芯中,过一会拿出铜丝,发现铜丝又变红。试说明变化理由。5.乙酸与乙醇的酯化反应中,浓硫酸的作用是什么?饱和碳酸钠溶液的作用是什么?6.乙酸与乙醇的酯化反应是可逆反应,在制取乙酸乙酯的实验中如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?7.有人认为乙酸与乙醇在催化作用下发生酯化反应有下列两种途径:途径(Ⅰ):途径(Ⅱ):根据课本所学的知识设计一个实验,并根据实验结论说明在什么情况下,按途径(Ⅰ)进行,什么情况下按途径(Ⅱ)进行。应用拓展:酯化反应是一个可逆反应,其逆反应是酯的水解。酯化反应随着羧酸和醇的结构以及反应条件的不同,可以按照不同的机理进行。酯化时,羧酸和醇之间脱水可以有两种不同的方式:(Ⅰ)(Ⅱ)(Ⅰ)是由羧酸中的羟基和醇中的氢结合成水分子,剩余部分结合成酯。由于羧酸分子去掉羟基后剩余的是酰基,故方式(Ⅰ)称为酰氧键断裂。(Ⅱ)是由羧酸中的氢和醇中的羟基结合成水,剩余部分结合成酯。由于醇去掉羟基后剩下烷基,故方式(Ⅱ)称为烷氧键断裂。当用含有标记氧原子的醇(...