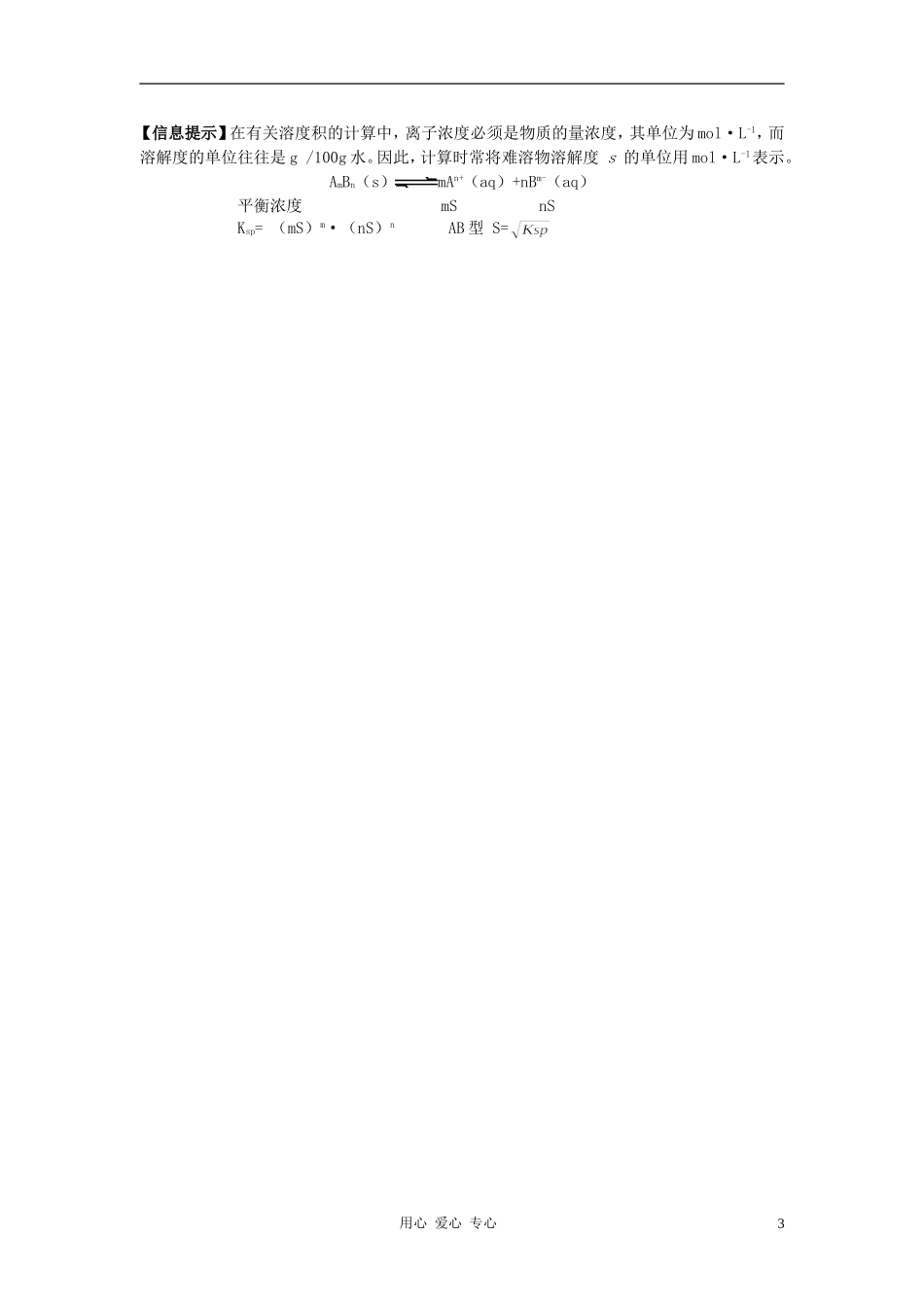
第1课时沉淀溶解平衡原理教学设计教学过程【问题思考】电解质在水中的溶解度,有的很大,有的很小。一般说20℃时,溶解度介于为微溶,小于的为难溶,介于的为可溶,大于的为易溶。AgCl、BaSO4等就属于难溶解物。那么他们在水中是否完全不溶解?0.01g~1g,0.01g,1g~10g,10g【活动与探究】(1)将少量PbI2(难溶于水)固体加入盛有一定量水的50mL烧杯中,用玻璃棒充分搅拌,静置一段时间。(2)取上层清液2mL加入试管中,逐滴加入AgNO3溶液,振荡,观察实验现象。请分析产生上述实验现象的原因:说明PbI2溶液中存在着I-,I-与Ag+反应生成AgI黄色沉淀。一、沉淀溶解平衡的建立:AgCl(s)Ag+(aq)+Cl—(aq)沉淀溶解过程——速率v1;沉淀生成过程——速率v2v1>v2v1=v2v1<v2溶解速率大于沉淀速率,AgCl处于溶解过程,沉淀量在减少溶解速率等于沉淀速率,形成AgCl饱和溶液,沉淀量不变溶解速率小于沉淀速率,AgCl处于沉淀过程,沉淀量在增加1、概念:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成溶质的饱和溶液,达到平衡状态,人们将这种平衡称为沉淀溶解平衡。【注意】此处的“”表示“溶解”和“沉淀”是相对的两方面,不表示电离。【问题思考】AgCl是我们熟悉的难溶物,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl。如果上述两种溶液是等物质的量浓度、等体积的。你认为Ag+和Cl—的反应真能进行到底吗?如何从沉淀溶解平衡的角度证明你的结论?2、沉淀溶解平衡的特征①②③④⑤逆:是一个可逆的过程等:v1=v2动:v1=v2≠0——动态平衡定:溶液中溶质的分子或离子的浓度不再变化。变:当条件改变时,溶质的溶解平衡可发生移动,达到新的平衡。【问题思考】写出AgCl(s)Ag+(aq)+Cl—(aq)的平衡常数表达式。Ksp=c(Ag+)·c(Cl-)3、溶度积常数:(简称溶度积)①定义难溶电解质在溶液中达到沉淀溶解平衡状态时,其平衡常数为离子浓度系数次方的乘积,为一定值,这个常数称之为溶度积常数简称为溶度积,用Ksp表示.②表达式用心爱心专心1AmBn(S)mAn++nBm-Ksp=cm(An+)·cn(Bm-)【练习】请写出PbI2、Cu(OH)2、BaSO4、CaCO3、Al(OH)3、CuS的沉淀溶解平衡与溶度积Ksp表达式Ksp=c(Pb2+)·c2(I-)Ksp=c(Cu2+)·c2(OH-)Ksp=c(Ba2+)·c(SO42-)Ksp=c(Ca2+)·c(CO32-)Ksp=c(Al3+)·c3(OH-)Ksp=c(Cu2+)·c(S2-)③意义Ksp反映了难溶电解质在水中的溶解能力【注意】对于同类型难溶物可用Ksp来比较溶解性大小,类型不同的难溶物则应转化为溶解度后再进行比较。④影响因素难溶电解质性质、温度等4、有关溶度积常数的计算①利用Ksp计算溶液中离子浓度原理:AmBn(s)mAn+(aq)+nBm-(aq)c(An+)=c(Bm-)=c(An+)=c(Bm-)=例1、已知在室温下,碘化铅的溶度积(Ksp)为7.1×10-9,试计算室温下碘化铅饱和溶液中Pb2+和I-的浓度。c(Pb2+)=1.21×10-3mol/Lc(I-)=2.42×10-3mol/L②溶度积规则Qc=Qc=【问题思考】Qc与Ksp的大小之间有什么关系?Qc>KspQc=KspQcKsp所以能沉淀完全③Ksp与溶解度(S)的关系。【交流与讨论】p88表3-14试从表中信息讨论难溶电解质的溶度积常数和溶解度的关系。对于同类型的难溶电解质而言,Ksp越小,其在水中的溶解能力也越小用心爱心专心2【信息提示】在有关溶度积的计算中,离子浓度必须是物质的量浓度,其单位为mol·L-1,而溶解度的单位往往是g/100g水。因此,计算时常将难溶物溶解度s的单位用mol·L-1表示。AmBn(s)mAn+(aq)+nBm-(aq)平衡浓度mSnSKsp=(mS)m·(nS)nAB型S=用心爱心专心3